题目内容
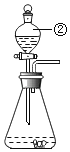
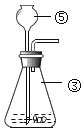
【题目】为了达到收旧、利废、节能减排的目的,从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:

请回答:
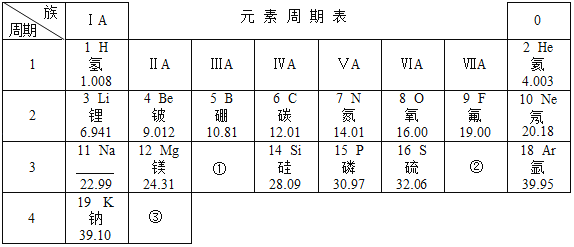
(1)操作①中被磁铁吸引的金属A是_____;金属B是_____。
(2)操作a的名称是_____;在过程中需要使用玻璃棒,其作用是_____。
(3)写出步骤②所涉及的化学反应方程式_____,该反应发生的基本类型是_____。判断步骤2是否适量的依据是:_____。若没有稀硫酸,还可以加入适量的_____溶液。
【答案】铁 铜 过滤 引流 Mg+H2SO4![]() MgSO4+H2↑ 置换反应 向溶液中加入镁,观察有无气泡产生 硫酸铜
MgSO4+H2↑ 置换反应 向溶液中加入镁,观察有无气泡产生 硫酸铜
【解析】
(1)铁具有铁磁性,能被磁铁吸引,因此A是铁;镁和铜的混合物中,加入适量的稀硫酸,镁和稀硫酸反应生成硫酸镁和氢气,铜不反应,因此过滤可以得到的金属B是铜。(2)通过过滤可将固体与液体分离,故该操作为过滤;在过滤过程中需要使用玻璃棒,其作用是引流。(3)镁和硫酸反应生成硫酸镁和氢气,其化学方程式为:Mg+H2SO4===MgSO4+H2↑;由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应。要判断稀硫酸是否过量,可以向溶液中加入镁,观察有无气泡产生;还可以利用金属与盐溶液的反应,可以加入硫酸铜溶液, Mg+ CuSO4 ==Cu+ MgSO4 ,得到化工原料MgSO4和金属铜。

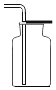
【题目】如图是实验室制取气体常用的发生装置和收集装置图示,请结合实验装置图示,完成下列问题:
气体发生装置 | 气体收集装置 | ||||
|
|
|
|
|
|
A | B | C | D | E | F |
(1)写出仪器标号的仪器名称:①_____②_____③_____④_____
(2)若用装置A制取氧气,反应的化学符号表达式_____。
(3)如用绿色制取氧气的方法,不仅能节约药品,还可以控制反应进行,应选用的气体发生装置是_____(填编号),写出该反应的化学符号表达式_____,如用E来收集O2,氧气应从_____(填“a或b”)端通入,如何验满_____。
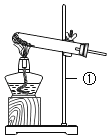
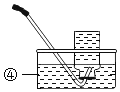
(4)制取气体,装入药品前,先检查气密性,检查装置C气密性的方法是_____,说明装置不漏气。
(5)常温下,硫化氢(H2S)是一种有臭鸡蛋气味的气体,能溶于水,密度大于空气,实验室通常在常温下用硫化亚铁固体(FeS)和稀硫酸反应制得,同时生成硫酸亚铁,则从上面装置中最好选择的发生装置是_____。选择的收集装置是_____,理由是_____
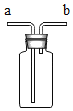
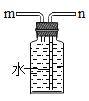
(6)常温下用块状电石(CaC2)与水反应制取难溶于水的乙炔气体(C2H2)并生成了氢氧化钙,请你认真写出该反应的化学符号表达式_____。实验室制取并收集纯净的乙炔,该反应非常剧烈,必须控制反应的速度。你选择的发生装置是_____和收集装置是_____如果用如图所示装置收集乙炔,气体应从_____(填“m”或“n”)端管口通入。
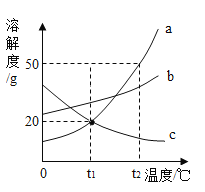
【题目】为探究双氧水浓度、温度、是否有催化剂等因素对双氧水分解产生氧气速率的影响某研究小组设计下表中的实验,并记录了相关数据。
实验序号 | 双氧水的浓度 | 双氧水体积(mL) | 温度(℃) | MnO2用量(g) | 产生125mL氧气所需时间(s) |
① | 5% | 20 | 20 | 0.2 | 11 |
② | 30% | 20 | 20 | 0.2 | 2 |
③ | 30% | 20 | 40 | 0 | 148 |
④ | 30% | 20 | 90 | 0 | 82 |
⑤ | ﹣﹣ |
(1)通过实验①和②对比,可以得出双氧水浓度对反应速率影响的结论是_____。
(2)通过实验_____(填实验序号,下同)和_____对比可知,反应的速率与温度有关。
(3)上述实验最适于实验室获得氧气的是_____,反应的化学方程式为_____。
(