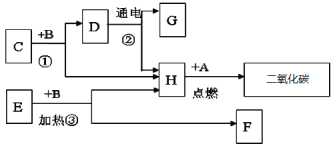
题目内容
【题目】水被誉为“生命之源”,在生产、生活中有重要的作用。
(1)如图1是电解水的装置示意图,其中发生反应的化学方程式为_____。在实验过程中,试管a中收集到的气体是_____。
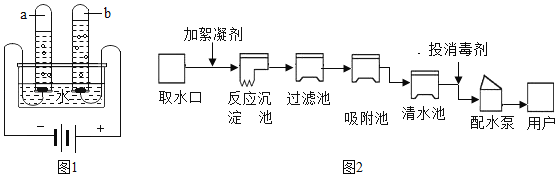
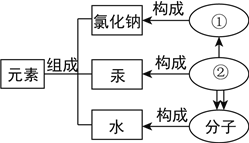
(2)电解水实验揭示了水是由_____组成的。
(3)自来水生产的简要流程可用如图2表示:
①能除去水中的固体杂质的是_____(填“过滤池”或“吸附池”);
②吸附池通常加有活性炭,其作用是_____;
③输送到用户家中的自来水_____(填“是”或“不是”)纯净物。请用简单的方法证明你的判断:_____。
【答案】2H2O![]() 2H2↑+O2↑ 氢气 氢元素和氧元素 过滤池 吸附有色物质和有异味的物质 不是 取样少许,滴在玻璃片上晾干,观察是否有残留痕迹
2H2↑+O2↑ 氢气 氢元素和氧元素 过滤池 吸附有色物质和有异味的物质 不是 取样少许,滴在玻璃片上晾干,观察是否有残留痕迹
【解析】
(1)电解水是在通电的条件下生成氢气和氧气,反应的化学方程式为:2H2O![]() 2H2↑+O2↑,在实验过程中,试管a中收集到的气体较多,根据电解水的实验现象和结论“正氧负氢,氢二氧一”可知较多的是氢气。
2H2↑+O2↑,在实验过程中,试管a中收集到的气体较多,根据电解水的实验现象和结论“正氧负氢,氢二氧一”可知较多的是氢气。
(2)电解水实验揭示了水是由氢元素和氧元素组成的。
(3)① 能除去水中的固体杂质的是过滤池,实现固体和液体分离;② 吸附池通常加有活性炭,其作用是吸附有色物质和有异味的物质;③ 自来水只是除去了不溶性物质以及可溶性的有色物质等,以及进行了杀菌消毒,没有除去所有的可溶性杂质,所以输送到用户家中的自来水不是纯净物。取少许水样,滴在玻璃片上晾干,观察是否有残留痕迹,若有残留,则是混合物。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案【题目】为探究双氧水浓度、温度、是否有催化剂等因素对双氧水分解产生氧气速率的影响某研究小组设计下表中的实验,并记录了相关数据。
实验序号 | 双氧水的浓度 | 双氧水体积(mL) | 温度(℃) | MnO2用量(g) | 产生125mL氧气所需时间(s) |
① | 5% | 20 | 20 | 0.2 | 11 |
② | 30% | 20 | 20 | 0.2 | 2 |
③ | 30% | 20 | 40 | 0 | 148 |
④ | 30% | 20 | 90 | 0 | 82 |
⑤ | ﹣﹣ |
(1)通过实验①和②对比,可以得出双氧水浓度对反应速率影响的结论是_____。
(2)通过实验_____(填实验序号,下同)和_____对比可知,反应的速率与温度有关。
(3)上述实验最适于实验室获得氧气的是_____,反应的化学方程式为_____。
(
【题目】某兴趣小组同学对实验室制备氧气的条件进行探究实验。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计对比实验:
Ⅰ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热;
Ⅱ.将xg氯酸钾与1.0g氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
Ⅰ中反应的符号表达式是_____,Ⅱ中x的值应为_____
(2)乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
双氧水的质量(g) | 双氧水的浓度 | 二氧化锰的质量(g) | 相同时间内产生氧气的体积(mL) | |
Ⅰ | 50.0 | 1% | 0.1 | 9 |
Ⅱ | 50.0 | 2% | 0.1 | 16 |
Ⅲ | 50.0 | 4% | 31 |
①取用二氧化锰的仪器是_____,实验Ⅲ中,加入二氧化锰的质量为_____g。
②实验结论:在相同条件下,_____,双氧水分解得越快。