题目内容
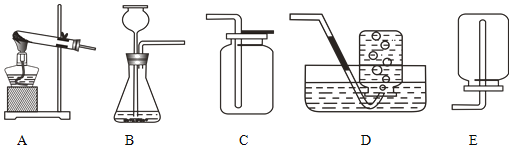
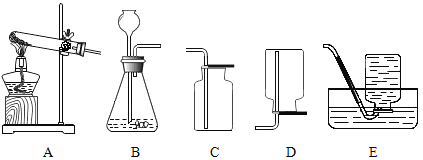
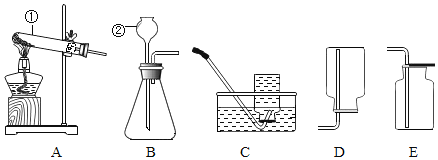
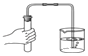
【题目】下图为氢气与氯气反应的示意图。

(1)集气瓶口出现白雾的原因是_______________________________________________。
(2)从微观角度分析能闻到刺激性气味的原因____________________________________;
该化学反应的微观实质是_________________________。
(3)该反应的化学方程为_______________________________________,基本反应类型__________________。
(4)从该反应谈谈你对燃烧条件的新识______________________________。
【答案】氯化氢气体与空气中的水蒸气结合形成的盐酸小液滴 分子在不断运动 分子分裂成原子,原子重新组合成新的分子 H2+Cl2![]() 2HCl 化合反应 燃烧需要的助燃剂不一定是氧气等
2HCl 化合反应 燃烧需要的助燃剂不一定是氧气等
【解析】
(1)氢气在氯气中燃烧产生氯化氢气体。集气瓶口出现白雾的原因是氯化氢气体与空气中的水蒸气结合形成的盐酸小液滴;
(2)从微观角度分析能闻到刺激性气味的原因分子在不断运动;该化学反应中氢分子离解成氢原子,氯分子离解成氯原子,氢原子与氯原子组合成氯化氢分子。该化学反应的微观实质是分子分裂成原子,原子重新组合成新的分子;
(3)氢气在氯气中燃烧产生氯化氢气体,反应的化学方程为:H2+Cl2![]() 2HCl,该反应是由两种物质生成一种物质,基本反应类型属于化合反应;
2HCl,该反应是由两种物质生成一种物质,基本反应类型属于化合反应;
(4)氢气能在氯气中燃烧,没有氧气参加。从该反应对燃烧条件的新识是燃烧需要的助燃剂不一定是氧气等。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】为探究双氧水浓度、温度、是否有催化剂等因素对双氧水分解产生氧气速率的影响某研究小组设计下表中的实验,并记录了相关数据。
实验序号 | 双氧水的浓度 | 双氧水体积(mL) | 温度(℃) | MnO2用量(g) | 产生125mL氧气所需时间(s) |
① | 5% | 20 | 20 | 0.2 | 11 |
② | 30% | 20 | 20 | 0.2 | 2 |
③ | 30% | 20 | 40 | 0 | 148 |
④ | 30% | 20 | 90 | 0 | 82 |
⑤ | ﹣﹣ |
(1)通过实验①和②对比,可以得出双氧水浓度对反应速率影响的结论是_____。
(2)通过实验_____(填实验序号,下同)和_____对比可知,反应的速率与温度有关。
(3)上述实验最适于实验室获得氧气的是_____,反应的化学方程式为_____。
(
【题目】某兴趣小组同学对实验室制备氧气的条件进行探究实验。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计对比实验:
Ⅰ.将3.0g氯酸钾与1.0g二氧化锰均匀混合加热;
Ⅱ.将xg氯酸钾与1.0g氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
Ⅰ中反应的符号表达式是_____,Ⅱ中x的值应为_____
(2)乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
双氧水的质量(g) | 双氧水的浓度 | 二氧化锰的质量(g) | 相同时间内产生氧气的体积(mL) | |
Ⅰ | 50.0 | 1% | 0.1 | 9 |
Ⅱ | 50.0 | 2% | 0.1 | 16 |
Ⅲ | 50.0 | 4% | 31 |
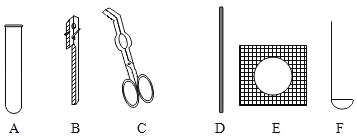
①取用二氧化锰的仪器是_____,实验Ⅲ中,加入二氧化锰的质量为_____g。
②实验结论:在相同条件下,_____,双氧水分解得越快。