题目内容
【题目】学习了二氧化锰对过氧化氢有催化作用的知识后。某同学想:氧化铜能否起到类似二氧化锰的催化剂作用呢?于是进行了如下探究。
(猜想)Ⅰ氧化铜不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ氧化铜参与反应产生氧气,反应前后质量和化学性质发生了改变;
Ⅲ氧化铜是反应的催化剂,反应前后_______________和_____________不变。
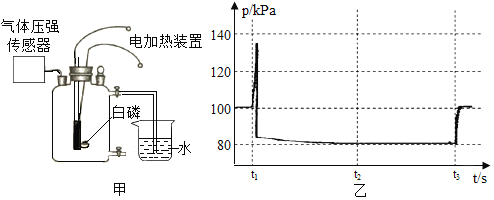
(实验)用天平称量![]() 氧化铜,取
氧化铜,取![]() 的过氧化氢溶液于试管中,进行如下实验:
的过氧化氢溶液于试管中,进行如下实验:
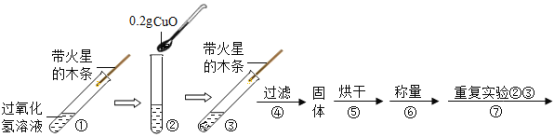
(1)填写下表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
①_____________ ②带火星的木条复燃 | 所得固体_________g | 溶液中有气泡放出 ②带火星的木条______(填“复燃”或“不复燃”) | 猜想Ⅰ、Ⅱ不成立猜想Ⅲ成立 |
(2)步骤①的目的是___________________。
(3)过氧化氢能被氧化铜催化分解放出氧气的化学反应的文字表达式为:___________________。
(4)过氧化氢反应生成氧气的快慢除了与是否使用催化剂有关,与催化剂的种类有关外,还与什么因素有关呢?请写出你的猜想并设计实验方案验证你的猜想。
①你的猜想是过氧化氢反应生成氧气的快慢与_________________有关;
②你的实验方案是:____________________。
【答案】质量 化学性质 产生大量气泡 0.2 复燃 与实验进行对比(或者:对比实验) ![]() 过氧化氢的浓度(答案合理即可) 取两份等体积等温度的过氧化氢溶液于试管中,一份为1%,一份为5%。分别加入等质量等颗粒大小的二氧化锰,观察产生气泡的剧烈程度(或者:测量相同时间内产生气体的体积)(答案合理即可)
过氧化氢的浓度(答案合理即可) 取两份等体积等温度的过氧化氢溶液于试管中,一份为1%,一份为5%。分别加入等质量等颗粒大小的二氧化锰,观察产生气泡的剧烈程度(或者:测量相同时间内产生气体的体积)(答案合理即可)
【解析】
猜想:Ⅲ.催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变。
(1)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃;故有:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
①产生大量气泡 ②带火星的木条复燃 | 所得固体0.2g | 溶液中有气泡放出 ②带火星的木条复燃 | 猜想Ⅰ、Ⅱ不成立猜想Ⅲ成立 |
(2)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论,所以步骤①的目的是:与实验进行对比;
(3)过氧化氢能被氧化铜催化分解放出氧气,同时生成水,反应的文字表达式为:![]() ;
;
(4)①过氧化氢反应生成氧气的快慢与过氧化氢的浓度有关;
②验证的实验方案是:取两份等体积等温度的过氧化氢溶液于试管中,一份为1%,一份为5%,分别加入等质量等颗粒大小的二氧化锰,观察产生气泡的剧烈程度。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】将一定量的丙醇(C3H8O)和氧气置于一个密封的容器中引燃,测得反应前后各物质的质量如表。下列说法错误的是( )
物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
反应前质量/g | 6.0 | 14.8 | 0 | 0.4 | 0 |
反应后质量/g | 0 | 2 | 7.2 | 9.2 | a |
A. 表中a的值为2.8
B. 参加反应的氧气和生成二氧化碳的质量比为16:11
C. X中一定含碳元素、氧元素
D. 该反应属于分解反应
【题目】学习了氧气的知识,兴趣小组同学对氧气在生活中的应用进行了探究。

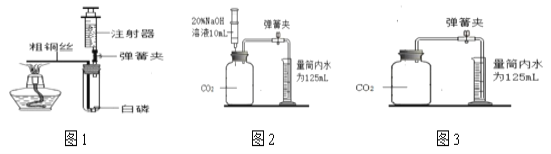
(查阅资料)家用制氧机(如图1)的工作原理如下:加压时,装填制氧机内部的分子筛吸附空气中的氮气,制取高浓度氧气:减压时,分子筛将所吸附的氮气排放,整个过程中,分子筛并不消耗。兴趣小组同学用家用制氧机制取并收集了一袋气体,带到实验室对其进行研究。
实验一:小组同学准备通过以下实验验证所收集的气体是否为纯净的氧气。
(实验记录)取一只250mL的集气瓶,用排水法收集一瓶所带气体,然后把一根燃着的木条插入集气瓶中,木条燃烧得更旺。
(实验结论)收集的气体是纯净的氧气。
(实验反思)老师指出上述实验并不能证明小组同学所带来的气体一定是纯净的氧气。该实验不能确定所收集气体为纯净氧气的原因是___________。
实验二:测定小组同学所带气体中氧气的含量。
同学们在老师的指导下设计了如图2所示装置,进行实验,并重复多次。请补充完实验记录。
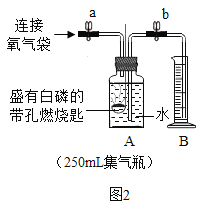
(实验步骤)
①检查____________。
②加入药品,将装置连接固定。
③打开止水夹a和b,向A中缓慢鼓入一定量气体,露出白磷后,关闭止水夹a和b, A中水进入到B中,测得B中水的体积为V1mL。
④用凸透镜聚光引燃白磷,白磷燃烧,产生大量白烟。
⑤待白磷熄灭并冷却到室温,进行_______操作。B中水倒吸进入A中,测得量筒中的体积变为V2mL 。
⑥计算小组同学所带气体中氧气的体积分数。
(1)请填(“不变”或“偏高”或“偏低”)
A 步骤③中,仰视量筒读数会使测得的V1数值____________;
B 步骤⑤中,未冷却至室温会使测得的小组同学所带气体中氧气的含量__________;
(2)(数据记录)
经测定V1=110mL; V2数据如下:
实验次序 | 1 | 2 | 3 | 4 | 5 |
B 中剩余水体积/mL | 27 | 26 | 50 | 24 | 23 |
(数据处理)
已知,在如表数据中,其中有一次数据偏差较大,存在明显误差,在数据处理时应删去。小组同学所带气体中氧气的体积分数为___________(保留小数点后一位有效数字)。
(实验反思)
①家用制氧机制氧气的过程发生的变化属于__________(填“物理变化”或“化学变化”)。
②用高锰酸钾制取氧气,由于制取成本较高,不适合大量生产,一般用于实验室制取。
③导致那次数据产生较大误差的可能原因是__________。
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是_____;
(2)表中所列3种催化剂的催化效果最佳的是_____;
(3)写出实验3中KClO3分解的化学方程式:_____;
(4)由实验1和实验4可知,KCl_____(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:_____;
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____;
(6)用图装置测量一定量的氯酸钾和二氧化锰加热分解后产生O2的体积,实验时应_____(选填“气泡连续均匀”或“刚有气泡”)时开始收集气体。

①以下是用该装置测量收集到的气体的体积必须包括的几个步骤:
A调整量筒内外液面使之相平
B使试管和量筒内的气体都冷却至室温
C读取量筒内气体的体积
这三步操作的正确顺序是:_____(请填写步骤代号)。
②若实验结束时,量筒内的液面高于水槽中的液面,要使量筒内外液面的高度相同可采用的操作是_____(填操作方法)。
③某同学在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为_____。
A 10.5% B 14.5% C 25.5% D 50%