题目内容
碳酸钙在高温条件下发生如下反应:CaCO3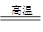 CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
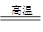 CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为| A.28.0 g | B.44.8 g |
| C.56.0 g | D.78.0 g |
A
试题分析:根据质量守恒定律可知,钙元素的质量在化学反应前后质量不变,根据已知的条件可以求出反应前钙元素的质量,然后再根据剩余固体中含钙元素的质量分数为41%,求出反应后剩余固体的总质量,根据反应前后的质量差,求出生成二氧化碳气体的质量,最后求出氧化钙的质量。
解:钙元素的质量=100g×80%×
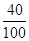 ×100%=32g;
×100%=32g;根据质量守恒定律可知,钙元素的质量在化学反应前后质量不变,则反应后剩余固体的总质量=32g÷41%≈78g;
根据质量守恒定律可知,生成二氧化碳的质量=100g-78g=22g
设生成的氧化钙的质量为x
CaCO3
 CaO + CO2↑
CaO + CO2↑56 44
x 22g
56:44=x:22g
解得,x=28g。 故选A
点评:此题是关于化学方程式的计算题,要求学生要有较强的分析能力,解题的关键是,要能利用质量守恒定律求出反应后物质质量和生成二氧化碳的质量,然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可。

练习册系列答案
相关题目