题目内容
某化学兴趣小组为了测定某黄铜(铜、锌合金)样品中锌的质量分数,取10g样品放入烧杯中,再取60g稀硫酸分六次加入烧杯中,充分反应,实验数据如下:
则:(1)黄铜样品中锌的质量分数为 。
(2)所用稀硫酸的溶质质量分数为多少?(写出计算步骤)
| | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 |
| 加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
| 剩余固体的质量(g) | 9.35 | 8.7 | 8.05 | 7.4 | 6.75 | 6.75 |
(2)所用稀硫酸的溶质质量分数为多少?(写出计算步骤)
(1)32.5% (2)9.8%
试题分析:(1)根据表格数据可知,前五次每次加入10g稀硫酸,都能反应消耗固体的质量为0.65g,而第6次再加入10g硫酸后,固体质量没有改变,说明黄铜中的锌已完全反应,即剩余固体为铜,且质量为6.75g,则该固体中锌的质量=10g-6.75g=3.25g,所以,黄铜样品中锌的质量分数=
 ×100%=32.5%。
×100%=32.5%。(2)根据上面的分析,可知每10g稀硫酸,能与0.65g锌完全反应,可利用锌的质量,结合化学方程式中的质量比,计算出10g稀硫酸中的硫酸的质量,进而计算出稀硫酸的溶质质量分数。
设稀硫酸中溶质质量为x
Zn + H2SO4 = ZnSO4 + H2↑
65 98
0.65g x
65:0.65g=98:x
解得x=0.98g
则稀硫酸中溶质质量分数为
 ×100%=9.8%
×100%=9.8%答:(1)黄铜样品中锌的质量分数为32.5%;(2)所用稀硫酸的质量分数为9.8%。
点评:此题是关于化学方程式的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力;解题的关键是要明确第几次加入硫酸后,样品中的锌已完全反应,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
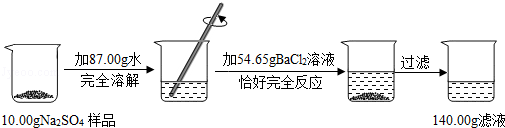



 2KCl + 3O2↑。现加热氯酸钾与二氧化锰的混合物30g,待氯酸钾完全反应后,称得剩余固体的质量为20.4g。求:
2KCl + 3O2↑。现加热氯酸钾与二氧化锰的混合物30g,待氯酸钾完全反应后,称得剩余固体的质量为20.4g。求: CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为