题目内容
黄铜是铜和锌的合金。向一定质量的黄铜样品中加入196g稀硫酸,恰好完全反应,产生0.2g氢气。
(1)(3分)求所用稀硫酸的溶质质量分数
(2)(3分)除了可求出稀硫酸的溶质质量分数外,你还能求出的化学量有 。(填序号,错选不得分)
①锌的质量 ②铜的质量分数 ③锌的质量分数 ④硫酸锌的质量 ⑤硫酸溶液的体积 ⑥反应后溶液溶质质量分数
(1)(3分)求所用稀硫酸的溶质质量分数
(2)(3分)除了可求出稀硫酸的溶质质量分数外,你还能求出的化学量有 。(填序号,错选不得分)
①锌的质量 ②铜的质量分数 ③锌的质量分数 ④硫酸锌的质量 ⑤硫酸溶液的体积 ⑥反应后溶液溶质质量分数
(1) 5%
(2)1、 4、 6 (选对一个化学量得1分。错选则不得分)
(2)1、 4、 6 (选对一个化学量得1分。错选则不得分)
试题分析:解:(1)设反应用去硫酸的质量为X。
Zn+H2SO4=ZnSO4+ H2↑
98 2
X 0.2g
98:2=X:0.2g
X=9.8g
所用稀硫酸的溶质质量分数为
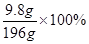 =5%。
=5%。(2)因为不知道黄铜的总质量,故除了可求出稀硫酸的溶质质量分数外,还能求出的化学量有:①锌的质量、④硫酸锌的质量、⑥反应后溶液溶质质量分数。
点评:本题难度较大,除了根据化学方程式计算外,还要根据已知条件推断可以解答的其他问题,这需要充分理解根据化学方程式计算的缘由。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
 2KCl + 3O2↑。现加热氯酸钾与二氧化锰的混合物30g,待氯酸钾完全反应后,称得剩余固体的质量为20.4g。求:
2KCl + 3O2↑。现加热氯酸钾与二氧化锰的混合物30g,待氯酸钾完全反应后,称得剩余固体的质量为20.4g。求:
 CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为