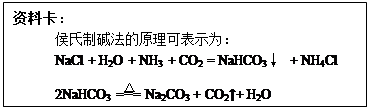
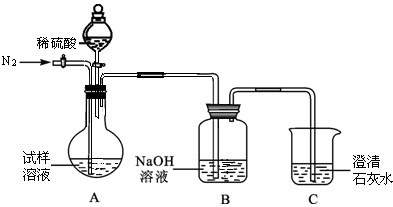
题目内容
(3分)某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100 g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得
实验数据如下表:
(资料:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl)
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量
分数。
实验数据如下表:
| 加入氢氧化钠溶液的总质量/g | 20 | 40 | 60 | 80 | 140 | 160 |
| 生成沉淀的质量/g | 0 | 0 | 1.07 | 2.14 | 5.35 | 5.35 |
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量
分数。
6%
试题分析:由题中数据可知:加入的氢氧化钠溶液的质量达到40g以前,都是氢氧化钠与滤液中的盐酸在反应,40g以后才是氢氧化钠与氯化铁反应,当生成沉淀的质量达到5.35g时,滤液中的物质已经不再发生反应,说明此时反应已经停止,故可以根据5.35g的数据来计算氢氧化钠的质量分数。次时加入的氢氧化钠溶液的总质量为:140-40=100g。
解:设与氯化铁反应的NaOH溶质的质量为x。
FeCl3+3NaOH = Fe(OH)3↓+3NaCl
120 107
x 5.35g
120 / x =" 107" / 5.35g
x=6g
NaOH% = 6g / (140g – 40g)×100%=" 6%"
答:略。
点评:分析题中数据,找到合适的数据带入计算是难点;根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

练习册系列答案
相关题目
 CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为 Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?
Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?