题目内容
锌粉、铝粉、镁粉的混合物3.8g与一定质量的稀硫酸恰好完全反应,将反应后的混合物蒸发水份得固体硫酸锌、硫酸铝、硫酸镁混合物11g,则反应中生成氢气的质量为
| A.0.15g | B.0.20g | C.0.30g | D.0.45g |
A
试题分析:由题意可知,硫酸锌、硫酸铝、硫酸镁混合物中硫酸根的质量为11g-3.8g=7.2g。
设,硫酸的质量为X。X·
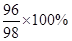 =7.2g,X=7.35g;反应产生的氢气的质量就是硫酸中的氢元素的质量,即7.35g×
=7.2g,X=7.35g;反应产生的氢气的质量就是硫酸中的氢元素的质量,即7.35g×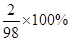 =0.15g。选A。
=0.15g。选A。点评:解答本题的关键是理解硫酸锌、硫酸铝、硫酸镁混合物中硫酸根的质量为11g-3.8g=7.2g,根据化合物中元素的质量分数计算出硫酸的质量,再由此来计算氢气的质量。

练习册系列答案
相关题目
 2KCl + 3O2↑。现加热氯酸钾与二氧化锰的混合物30g,待氯酸钾完全反应后,称得剩余固体的质量为20.4g。求:
2KCl + 3O2↑。现加热氯酸钾与二氧化锰的混合物30g,待氯酸钾完全反应后,称得剩余固体的质量为20.4g。求: CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
CaO+CO2↑,将100 g含CaCO3质量分数为80 %的石灰石样品(杂质不发生反应,也不含钙元素),高温煅烧一段时间后,冷却,测得剩余固体中含钙元素的质量分数为41%,则生成的CaO的质量约为
 4NH3 + 3O2。计算生产136t NH3所需N2的质量。
4NH3 + 3O2。计算生产136t NH3所需N2的质量。 Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?
Si + 4HCl。若要制得14g硅,参加反应的氢气质量是多少克?