题目内容
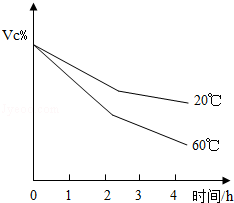
某校化学兴趣小组同学用一瓶含有少量氯化钠的硫酸钠固体样品,进行如下图所示的实验。
已知:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
请根据以上信息,计算反应后所得溶液中溶质的质量分数。
解:生成BaSO4的质量为:10g + 87g + 54.65g - 140g =" 11.65" g
设样品中硫酸钠的质量为x,生成氯化钠的质量为y
Na2SO4 + BaCl2 =BaSO4↓ + 2NaCl
142 233 117
x 11.65g y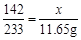
x = 7.1g
y = 5.85g
反应后溶液中溶质的质量为:(10g-7.1g)+ 5.85g = 8.75g
反应后溶液中溶质的质量分数为:
答:反应后所得溶液中溶质的质量分数为6.25%。
解析试题分析:根据质量守恒定律,反应前物质的总质量等于反应后物质的总质量:
Na2SO4的质量+水的质量+ BaCl2溶液的质量= BaSO4沉淀的质量+NaCl质量
BaSO4沉淀不溶于水,不是溶液的质量,故生成BaSO4的质量为:10g + 87g + 54.65g - 140g =" 11.65" g
由BaSO4沉淀的质量,列比例式计算出参加反应的硫酸钠的质量7.1g,求出样品中含有NaCl的质量10g-7.1g="2.9" g 再加上生成NaCl的质量就是反应后溶质的总质量:反应后溶液中溶质的质量为:2.9 g + 5.85g = 8.75g
根据溶质的质量分数= ×100%=
×100%=
考点:化学方程式的计算、溶质的质量分数计算

某化工厂生产的纯碱产品(含有少量氯化钠)的包装袋上注明:碳酸钠≥96%.
为了测定该产品中碳酸钠的质量分数是否属实,向4个分别盛有浓度相同、质量均为100g稀盐酸的烧杯中,分别放入不同质量的纯碱产品,充分反应后,称量烧杯中剩余物的质量,实验数据如下表:
| 所称量的物质 | 实验1 | 实验2 | 实验3 | 实验4 |
| 加入纯碱产品质量/g | 2.8 | 5.6 | 11.2 | 14 |
| 烧杯中剩余物质量/g | 101.7 | 103.4 | 106.8 | 109.6 |
请计算(最后结果保留一位小数):
(1)该纯碱产品中碳酸钠质量分数的标注是否真实.
(2)所用盐酸溶液中溶质的质量分数.
(3)恰好完全反应时,所得溶液中溶质的质量分数.
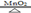 KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答:
KCl + 3O2↑。现将 29.4g 氯酸钾与 5.6g 二氧化锰的混合物加热一段时间后,冷却,称量剩余固体的质量为 25.4g。回答: