题目内容
已知烧杯中装有200g硫酸和硫酸锌混合溶液,其中含硫酸锌12.1g.向烧杯中逐渐加入锌粒,放出气体质量与加入锌粒质量的关系如图所示.当恰好完全反应时,所得的溶液为不饱和溶液.请计算:
(1)m=_________(2)原混合溶液中H2SO4的质量分数为_________.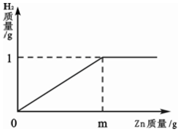
(1) 32.5 (2)24.5%
解析试题分析:(1)据右上图可知,最终生成的氢气质量是1g,根据发生的化学反应方程式:H2SO4 +Zn =ZnSO4 + H2↑中锌与氢气的质量关系,即可算出消耗的锌的质量,同理,根据H2SO4和氢气的质量关系,也可算出硫酸的质量,再利用质量分数的表达式即可求解:
解:设参加反应锌的质量为m,消耗H2SO4的质量为x
H2SO4 +Zn = ZnSO4 + H2↑
98 65 2
X m 1g
65:2=m:1g ∴m=32.5g
98:2=x:1g ∴x=49g 原混合溶液中H2SO4的质量分数为=49g/200g×100%=24.5%
考点:根据化学方程式进行计算

某化学兴趣小组对一包干燥的红色粉末组成进行探究,该红色粉末可能由Cu 、Fe2O3两种固体中的一种或两种组成。
【提出猜想】红色粉末可能是:①Cu ②Fe2O3 ③Cu和Fe2O3
【查阅资料】(1)白色无水CuSO4遇水变蓝
(2)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
【实验探究】
[甲组同学]:定性检测该红色粉末的物质组成
(1)小云取少量红色粉末于试管中,滴加足量稀盐酸,充分振荡后观察,发现固体全部溶解,得有色溶液。则猜想 一定不成立,其中一定发生反应的化学方程式为 。
(2)小伟向小云得到的有色溶液中插入一根洁净的铁丝,反应充分后,观察到
现象,得出猜想③成立。
[乙组同学]:定量测定该红色粉末中氧化铁的质量分数
实验步骤:小晨称取该红色粉末5.0g装入硬质玻璃管中,按下图进行实验。开始时缓缓通入CO气体,过一段时间后再高温加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关物质的总质量(装置内空气中的水蒸气、CO2忽略不计),其数据如下表: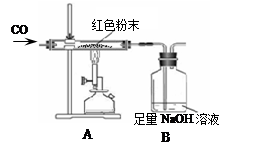
| | 反应前 | 反应后 |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3 g | 玻璃管和固体物质的总质量为47.1 g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6 g | 洗气瓶和瓶中所盛物质的总质量为261.9 g |
【交流讨论】
(1)在装置A中先通CO气体的目的是 。A装置中发生反应的化学方程式为 。
(2)根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为 。
(3)从环保角度看上述装置有严重不足之处。你认为应该如何改进? 。
【拓展延伸】对实验后B装置洗气瓶内溶液做进一步探究
实验步骤:小渊同学取该洗气瓶内溶液54.4克(假设溶质只有碳酸钠一种),逐滴加入稀盐酸50克至无气泡冒出为止,生成二氧化碳4.4克。试计算:
(1)加入稀盐酸的溶质质量分数。
(2)反应后所得溶液的溶质质量分数。
某同学需测定某100g过氧化氢溶液中所含过氧化氢的质量。他取10g二氧化锰放入烧杯中,并将该过氧化氢溶液全部加入,不同时间用电子天平测量其质量,所得读数如下表所示:
| 反应时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| 烧杯及所盛物质总质量/g | 335.70 | 334.30 | 334.00 | 333.50 | 333.00 | 332.50 | 332.50 |
(1)试分析,100g过氧化氢溶液完全反应后生成氧气的质量为 。(2分)
(2)计算100g过氧化氢溶液中过氧化氢质量分数为多少?(写出计算过程)(6分)
(3)请分析该方法测定结果可能会偏大的原因有 (写出一点即可)(2分)
目前市场上的补钙药剂很多,下图是某品牌补钙药品的部分说明书。为测定其含量是否达标,某兴趣小组的同学取10片钙片研碎后放于烧杯中,将100g稀盐酸分五次加入到烧杯中,并不断搅拌,称量,将得到的有关数据记录如下(钙片中其它成分不与稀盐酸反应):
| XXX钙片 [药品规格]每片1g [药品含量]含CaCO380% [用法用量]每次一片,每天2次 |
| 加入稀盐酸的质量/g | 0 | 20 | 40 | 60 | 80 | 100 |
| 烧杯中剩余物质质量/g | 10 | 29.12 | 48.24 | 67.36 | 86.48 | 106.48 |
请你根据题给信息和表中数据,回答下列问题:
(1)实验过程中将钙片研碎的目的是: 。
(2)完全反应后,产生二氧化碳的质量为 g
(3)试通过计算说明,该品牌钙片含量是否达标。
(4)如果按用量服用,服用者每天通过该补钙剂摄入钙元素的质量为 g

 Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。
Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。
