题目内容
【题目】用Ba(OH)2溶液测定某种氮肥中(NH4)2SO4的质量分数(杂质溶于水,但不参加反应).实验如下:称取该氮肥20g加水完全溶解,向该溶液中不断滴入Ba(OH)2溶液,生成气体及沉淀质量与加入Ba(OH)2溶液的质量关系如下所示: 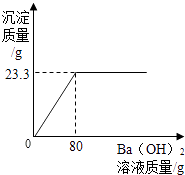
实验次序 | 1 | 2 | 3 |
滴入Ba(OH)2溶液的质量/g | 20 | 40 | 60 |
生成气体的质量/g | 0.85 | m | 2.55 |
试分析并计算:[已知:(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑]
(1)表格中m的值为g.
(2)实验所用氢氧化钡溶液中溶质的质量分数.
(3)该氮肥中(NH4)2SO4的质量分数.(计算结果精确至0.1%)
【答案】
(1)1.70
(2)解:设所用氢氧化钡的质量为x,(NH4)2SO4的质量为y,硫酸钡沉淀的质量为2.33g
(NH4)2SO4+ | Ba(OH)2= | BaSO4↓+2H2O+2NH3↑ |
132 | 17 | 1233 |
y | x | 23.3g |
![]()
y=13.2g
![]()
x=17.1g
实验所用氢氧化钡溶液中溶质的质量分数 ![]() 100%=21%
100%=21%
(3)解:设所用氢氧化钡的质量为x,(NH4)2SO4的质量为y,硫酸钡沉淀的质量为2.33g
(NH4)2SO4+ | Ba(OH)2= | BaSO4↓+2H2O+2NH3↑ |
132 | 17 | 1233 |
y | x | 23.3g |
![]()
y=13.2g
![]()
x=17.1g
该氮肥中(NH4)2SO4的质量分数 ![]() 100%=66%
100%=66%
【解析】解:(1)根据表中信息可知,20gBa(OH)2溶液与硫酸铵反应,生成氨气0.85g,到60gBa(OH)2溶液与硫酸铵反应,生成氨气2.55g,说明每20gBa(OH)2溶液与硫酸铵反应,能生成氨气0.85g,40gBa(OH)2溶液与硫酸铵反应,能生成氨气1.70g,故m的值为1.7g; 设所用氢氧化钡的质量为x,(NH4)2SO4的质量为y,硫酸钡沉淀的质量为2.33g
(NH4)2SO4+ | Ba(OH)2= | BaSO4↓+2H2O+2NH3↑ |
132 | 17 | 1233 |
y | x | 23.3g |
![]()
y=13.2g![]()
x=17.1g(2)实验所用氢氧化钡溶液中溶质的质量分数 ![]() 100%=21%(3)该氮肥中(NH4)2SO4的质量分数
100%=21%(3)该氮肥中(NH4)2SO4的质量分数 ![]() 100%=66%答案:(1)1.70(2)实验所用氢氧化钡溶液中溶质的质量分数21%(3)该氮肥中(NH4)2SO4的质量分数66%
100%=66%答案:(1)1.70(2)实验所用氢氧化钡溶液中溶质的质量分数21%(3)该氮肥中(NH4)2SO4的质量分数66%
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.