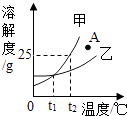
题目内容
【题目】下列各图中 ![]() 和
和 ![]() 分别表示两种不同元素的原子.有关说法正确的是( )
分别表示两种不同元素的原子.有关说法正确的是( )
A.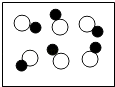 图表示混合物
图表示混合物
B. 图表示单质
图表示单质
C.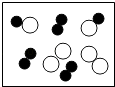 图表示化合物
图表示化合物
D.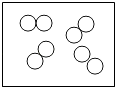 图可能是氧化物
图可能是氧化物
【答案】B
【解析】解:A、图中只有一种物质,属于纯净物中的化合物,不是混合物,故A错误; B、图中只有一种物质,属于纯净物中的单质,故B正确;
C、图中是三种物质的混合物,不是化合物,故C错误;
D、图中只有一种物质,属于纯净物中的单质,不是氧化物,故D错误.
故选:B.
【考点精析】解答此题的关键在于理解从组成上识别氧化物的相关知识,掌握氧化物必须是由两种元素组成,而且是化合物.如:H2O、AI2O3、HCI 都是氧化物,它们也属于化合物,又是纯净物,以及对纯净物和混合物的判别的理解,了解纯净物是由同一种物质组成的物质.它包括单质和化合物.混合物是由多种物质组成的物质.混合物也可以由单质组成,如氢气和氧气在一起,就是由单质组成的混合物.总之混合物里至少有两种或两种以上的物质.

【题目】用Ba(OH)2溶液测定某种氮肥中(NH4)2SO4的质量分数(杂质溶于水,但不参加反应).实验如下:称取该氮肥20g加水完全溶解,向该溶液中不断滴入Ba(OH)2溶液,生成气体及沉淀质量与加入Ba(OH)2溶液的质量关系如下所示: 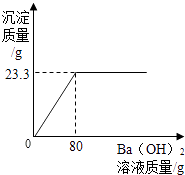
实验次序 | 1 | 2 | 3 |
滴入Ba(OH)2溶液的质量/g | 20 | 40 | 60 |
生成气体的质量/g | 0.85 | m | 2.55 |
试分析并计算:[已知:(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑]
(1)表格中m的值为g.
(2)实验所用氢氧化钡溶液中溶质的质量分数.
(3)该氮肥中(NH4)2SO4的质量分数.(计算结果精确至0.1%)
【题目】小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:Na2CO3+CO2+H2O=2NaHCO3 . 出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体. 【提出问题】白色固体是什么?
(1)【作出猜想】 猜想Ⅰ:只有Na2CO3;
猜想Ⅱ:可能是Na2CO3和NaOH的混合物;
猜想Ⅲ:
【査阅资料】
①碳酸氢钠不稳定受热易分解2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
②Na2CO3与NaOH的热稳定性较好
③CaCl2和NaCl的水溶液呈中性
【设计实验】
取一定量的白色固体,加热,若固体质量不变,猜想错误;若固体质量减少,则二氧化碳与氢氧化钠反应后,过量.
(2)【交流讨论】 小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行?;理由是 .
(3)【继续探究】白色固体中是否有氢氧化钠?
实验操作 | 实验现象 | 目的/结论 |
①取白色固体适量配制成溶液.往所得溶液中滴加过量的 , 充分反应后,过滤. | 有白色沉淀生成 | 除去白色固体中的 |
②取滤液,往滤液中滴入几滴 | 白色固体中没有氢氧化钠 |
【交流与反思】
由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意 .