题目内容
【题目】按照物质分类及化合价规律排列的:Mn、S、MnO2、SO2、K2MnO4、 ![]() 六种物质中,最后一种物质化学式为( )
六种物质中,最后一种物质化学式为( )
A.H2S
B.Na2SO3
C.CuSO4
D.Cu2S
【答案】C
【解析】解:根据单质中元素的化合价是零可知,Mn、S中元素的化合价都是0;氧显﹣2价,根据在化合物中正负化合价代数和为零可知MnO2中锰显+4价,SO2中硫显+4价;钾显+1价,根据在化合物中正负化合价代数和为零可知,K2MnO4中锰显+6价,观察可知,锰元素的化合价应是按0、+4、+6排列的,硫元素的化合价也应是按0、+4、+6排列. A、氢元素显+1价,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x=0,则x=﹣2价;
B、钠元素显+1价,氧元素显﹣2价,设硫元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:(+1)×2+y+(﹣2)×3=0,则y=+4价;
C、铜元素显+2价,氧元素显﹣2价,设硫元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:(+2)+z+(﹣2)×4=0,则z=+6价;
D、铜元素显+1价,设硫元素的化合价是m,根据在化合物中正负化合价代数和为零,可得:(+1)×2+m=0,则m=﹣2价;
故选C.
根据单质中元素的化合价是零、化合物中正负化合价代数和为零结合各化学式进行解答.

 一线名师权威作业本系列答案
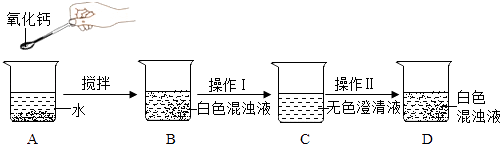
一线名师权威作业本系列答案【题目】用Ba(OH)2溶液测定某种氮肥中(NH4)2SO4的质量分数(杂质溶于水,但不参加反应).实验如下:称取该氮肥20g加水完全溶解,向该溶液中不断滴入Ba(OH)2溶液,生成气体及沉淀质量与加入Ba(OH)2溶液的质量关系如下所示: 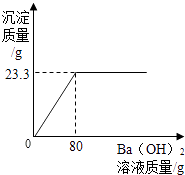
实验次序 | 1 | 2 | 3 |
滴入Ba(OH)2溶液的质量/g | 20 | 40 | 60 |
生成气体的质量/g | 0.85 | m | 2.55 |
试分析并计算:[已知:(NH4)2SO4+Ba(OH)2=BaSO4↓+2H2O+2NH3↑]
(1)表格中m的值为g.
(2)实验所用氢氧化钡溶液中溶质的质量分数.
(3)该氮肥中(NH4)2SO4的质量分数.(计算结果精确至0.1%)
【题目】小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:Na2CO3+CO2+H2O=2NaHCO3 . 出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体. 【提出问题】白色固体是什么?
(1)【作出猜想】 猜想Ⅰ:只有Na2CO3;
猜想Ⅱ:可能是Na2CO3和NaOH的混合物;
猜想Ⅲ:
【査阅资料】
①碳酸氢钠不稳定受热易分解2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
②Na2CO3与NaOH的热稳定性较好
③CaCl2和NaCl的水溶液呈中性
【设计实验】
取一定量的白色固体,加热,若固体质量不变,猜想错误;若固体质量减少,则二氧化碳与氢氧化钠反应后,过量.
(2)【交流讨论】 小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行?;理由是 .
(3)【继续探究】白色固体中是否有氢氧化钠?
实验操作 | 实验现象 | 目的/结论 |
①取白色固体适量配制成溶液.往所得溶液中滴加过量的 , 充分反应后,过滤. | 有白色沉淀生成 | 除去白色固体中的 |
②取滤液,往滤液中滴入几滴 | 白色固体中没有氢氧化钠 |
【交流与反思】
由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意 .