题目内容
【题目】(1)某兴趣小组准备通过锌与稀硫酸反应产生的氢气来测定稀硫酸中溶质的质量分数,装置如下:
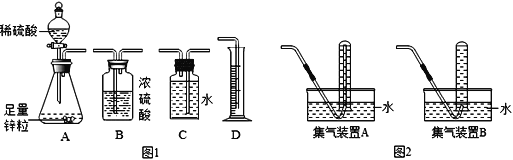
①小明同学用如图1所示装置进行实验,你认为他应该选择的最简易的装置及其连接顺序是:A→______→ D。
②小明若用图2装置收集氢气,应选择集气装置____(填“A”或“B”),为保证测量结果的准确性,收集气体的时机是_________。
a.导管口还没有气泡产生时
b.导管口连续均匀冒出气泡时
c.导管口冒出气泡很多时
③小张同学用如图3所示装置进行了实验:
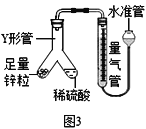
Ⅰ.下列能说明装置气密性良好的是_________。
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差。
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平。
Ⅱ.反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐渐减小的原因是_________________(排除仪器和实验操作的影响因素)。
Ⅲ.若实验中测得稀硫酸的溶质质量分数偏大,下列可能的原因是____________。
a.装置漏气 b.读取数据时水准管的水面高于量气管的水面
c.未待冷却就读取量气管读数
(2)在金属活动性顺序表中,排在前面的金属能把位于后面的金属从它的盐溶液中置换出来,但小明在做金属钠与硫酸铜溶液反应的实验时,却出现了异常现象。
【进行实验】取一块绿豆大小的金属钠,放入盛有20毫升硫酸铜溶液的小烧杯中,发现金属钠浮在液面上不停打转,产生大量气体,烧杯发烫,溶液中出现了蓝色絮状沉淀,一会儿部分沉淀渐渐变黑,将反应后烧杯中的混合物进行过滤,得滤渣和无色滤液。
【提出问题】①生成的气体是什么?
②滤渣的成分是什么?
③无色滤液中的溶质是什么?
【查阅资料】①钠能与水反应生成一种碱,同时放出气体。
②氢氧化铜受热至60~80℃变暗,温度再高分解为相应的金属氧化物(化合价不变)和水。
【实验探究一】 探究生成的气体是什么?
小明将上述实验药品放入锥形瓶中,立即塞上带导管的单孔塞,把气体通入肥皂水中,将燃着的木条靠近飘起的肥皂泡,有爆鸣声。说明生成的气体是___________。
【实验探究二】 探究滤渣的成分是什么?
【猜想假设】滤渣中含有Cu(OH)2和_____________,还可能含有Cu。
【实验验证】
实验步骤 | 实验现象 | 结论 |
取少量滤渣,向其中加入足量的稀硫酸 | ____________________ | 滤渣中没有Cu |
【实验结论】通过实验,小明同学得出结论:钠加入到硫酸铜溶液中会先与水反应,生成物再与硫酸铜反应生成氢氧化铜。请写出上述发生的两个反应的化学方程式______________ ,________________。
【实验探究三】探究无色滤液的溶质是什么?
【猜想假设】猜想① Na2SO4 , 猜想②________________。
【实验验证】
实验步骤 | 实验现象 | 结论 |
取少量无色滤液,向其中加入__________ | 无明显变化 | 猜想①成立 |
【反思交流】钠加入硫酸铜溶液中出现黑色物质的可能原因是(用化学方程式表示)_________。
【答案】 C B a A 反应放热、气体在冷却过程中体积逐渐减小 c H2 CuO 固体全部溶解、溶液变成蓝色 2Na + 2H2O = 2NaOH + H2↑ CuSO4+2NaOH = Cu(OH)2↓+Na2SO4 Na2SO4和NaOH 无色酚酞试液 Cu(OH)2![]() CuO + H2O
CuO + H2O
【解析】①最简易的装置及其连接顺序是:A→C→ D。用C收集氢气,同时通过读取压入D中水的体积,测定收集到氢气的体积,因为进入C的气体体积等于进入D的水的体积;②收集氢气,应选择集气装置B,A中导管太长,不易于操作;为保证测量结果的准确性,收集气体的时机是导管口连续均匀冒出气泡时,太早,收集的气体不纯,太晚,会导致收集的气体偏少; ③ Ⅰ. A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差。说明装置不漏气,在压力差的作用下形成液面差;B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平,说明两边液面上的压强始终都等于大气压,说明装置内始终和大气相同,即漏气;Ⅱ.气体体积逐渐减小的原因是反应放热,气体在冷却过程中随压强变小,体积逐渐减小,Ⅲ.通过锌与稀硫酸反应产生的氢气来测定稀硫酸中溶质的质量分数,就是利用氢气计算硫酸,若实验中测得稀硫酸的溶质质量分数偏大,应该是测定的氢气比实际偏多, a.装置漏气导致气体体积偏少; b.读取数据时水准管的水面高于量气管的水面,导致气体压强增大,气体被压缩,体积应变小; c.未待冷却就读取量气管读数 ,由于气体受热膨胀,导致测定结果偏大;故选C;(2)【实验探究一】将燃着的木条靠近飘起的肥皂泡,有爆鸣声。说明生成的气体是氢气;【猜想假设】据质量守恒定律,反应前后元素的种类不变,滤渣中含有Cu(OH)2和氧化铜,还可能含有Cu;【实验验证】铜不能与常见的酸溶液反应,取少量滤渣,向其中加入足量的稀硫酸,没有固体剩余,说明滤渣中没有Cu;【实验结论】钠加入到硫酸铜溶液中会先与水反应,生成物再与硫酸铜反应生成氢氧化铜。上述发生的两个反应的化学方程式2Na + 2H2O = 2NaOH + H2↑ ,CuSO4+2NaOH = Cu(OH)2↓+Na2SO4;【猜想假设】溶液为无色,说明硫酸铜完全反应,猜想①刚好完全反应时溶质为 Na2SO4 ,当氢氧化钠过量时,所得溶液中的溶质为硫酸钠和氢氧化钠;取少量无色滤液,向其中加入酚酞试液,无明显变化,说明无氢氧化钠, 猜想①成立;【反思交流】钠加入硫酸铜溶液中出现黑色物质的可能原因是氢氧化铜受热分解生成氧化铜,方程式为:Cu(OH)2![]() CuO + H2O。
CuO + H2O。

【题目】食盐(NaCl)、碳酸钠(Na2CO3)、生石灰(CaO)是制作皮蛋料泥的主要原料。制作料泥时,将上述原料加入适量水中,搅拌混合均匀即可。
(1)①制作料泥时,生石灰与水反应的化学方程式是__________________。
②制作料泥时,与碳酸钠反应的物质是_____________________(写化学式)。
(2)某化学兴趣小组对影响溶液碱性强弱的因素展开探究。用不同温度的水,配制溶质质量分数分别为2%、6%和10%的碳酸钠溶液,依次测量溶液的pH,记录数据如下表:
实验编号 | a1 | a2 | a3 | b1 | b2 | b3 | c1 | c2 | c3 |
溶质质量分数 | 2% | 2% | 2% | 6% | 6% | 6% | 10% | 10% | 10% |
水的温度(℃) | 20 | 40 | 60 | 20 | 50 | 60 | 20 | 50 | 70 |
溶液pH | 10.90 | 11.18 | 11.26 | 11.08 | 11.27 | 11.30 | 11.22 | X | 11.50 |
请你分析表中数据回答:
①溶液碱性最强的是___________(填实验编号)
②实验a1、b1、c1的实验目的是________________________。
③在相同的条件下,一定温度范围内,温度与碳酸钠溶液pH的关系是____________________。
④表格中X的数值可能是____________(填选项)。
A.11.20 B.11.25 C.11.37 D.11.62
【题目】锂、锰两种金属用途很广。
(1)手机电池中存在LiMnO2,已知锂元素显+1价,则锰元素的化合价为___。电池充电时是将电能转化为__(填字母):A.机械能 B.化学能 C.热能
(2)锂、锰的碳酸盐也有广泛的用途。
Ⅰ.粗碳酸锂(含有Na+、K+、Ca2+等杂质离子)制备高纯碳酸锂的工艺流程如下:(已知碳酸锂能与水、二氧化碳反应生成碳酸氢锂,碳酸氢锂不稳定,受热后会分解为碳酸锂)
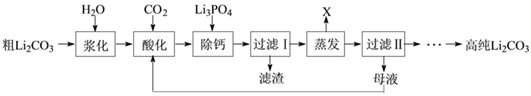
碳酸锂易溶于水,碳酸锂溶解度与温度的关系见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
①浆料“酸化”时,温度不宜超过25℃的主要原因是______。判断酸化过程已经结束的明显现象为______。
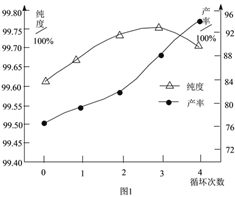
②“蒸发”时主要反应的化学方程式为______。母液循环次数对纯度、产率的影响如图1所示,循环不宜超过______次,主要原因是______。
③为了获得较多高纯Li2CO3,过滤Ⅱ后用______(填“热水”或“冷水”)洗涤沉淀2-3次,并干燥。其原因是____。
Ⅱ.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
已知:MnCO3难溶于水和乙醇,受热易分解。
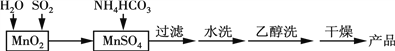
①检验水洗是否完全的方法是______。
②水洗结束后,用乙醇洗涤的目的是______。
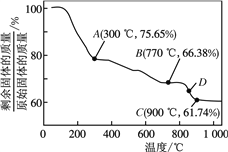
③MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如下图所示。通过计算可知,300℃时,剩余固体中n(Mn)∶n(O)=1:2,即可认为A物质化学式为MnO2,同时测得反应生成了二氧化碳,请写出0~300℃发生反应的化学方程式______。图中点D对应固体的成分为_____(填化学式,并写出计算过程)。
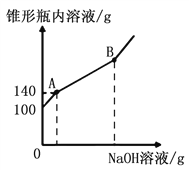
【题目】实验小组在向氢氧化钠溶液中滴加稀盐酸进行中和反应操作时,忘记预先在氢氧化钠溶液中加入酚酞试液,为判断反应进行的程度,决定对反应后溶液的性质进行以下探究:
【猜想假设】猜想①盐酸不足量;猜想②恰好完全中和猜想③盐酸过量
【方案设计】(并填写表中的空格)
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 取适量反应后的溶液于试管中,滴加几滴无色的酚酞试液,振荡 | ___________ | 猜想①正确 |
方案二 | 用一根洁净的玻璃棒蘸取反应后的溶液滴在pH试纸上,把试纸呈现的颜色与标准比色卡对照 | pH=7 | ____________ |
方案三 | 取适量锌粒于试管中,加入适量反应后的溶液 | ____________ | 猜想③正确 |
【解释结论】滴加的盐酸与氢氧化钠发生反应,反应的方程式为______________
【评价反思】甲同学按方案一进行实验,观察到溶液未变色,则甲同学可以得出的结论是______(填字母序号)
A. 猜想②正确 B. 猜想③正确 C. 猜想②或③正确
理由是_______________________.
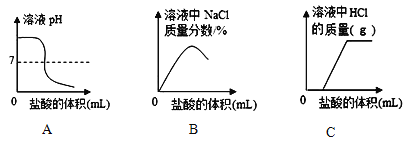
【拓展迁移】向一定量一定质量分数的氢氧化钠溶液中逐滴加入稀盐酸,有关分析错误的是______