题目内容
【题目】锂、锰两种金属用途很广。
(1)手机电池中存在LiMnO2,已知锂元素显+1价,则锰元素的化合价为___。电池充电时是将电能转化为__(填字母):A.机械能 B.化学能 C.热能
(2)锂、锰的碳酸盐也有广泛的用途。
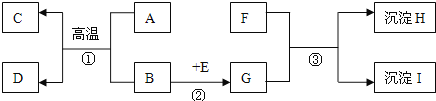
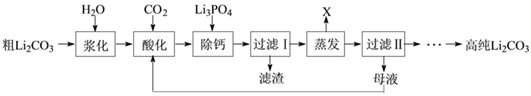
Ⅰ.粗碳酸锂(含有Na+、K+、Ca2+等杂质离子)制备高纯碳酸锂的工艺流程如下:(已知碳酸锂能与水、二氧化碳反应生成碳酸氢锂,碳酸氢锂不稳定,受热后会分解为碳酸锂)
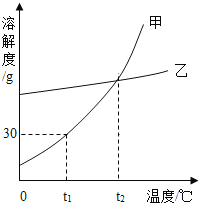
碳酸锂易溶于水,碳酸锂溶解度与温度的关系见下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
①浆料“酸化”时,温度不宜超过25℃的主要原因是______。判断酸化过程已经结束的明显现象为______。
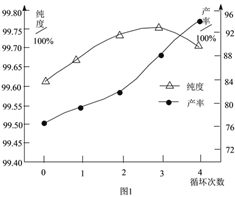
②“蒸发”时主要反应的化学方程式为______。母液循环次数对纯度、产率的影响如图1所示,循环不宜超过______次,主要原因是______。
③为了获得较多高纯Li2CO3,过滤Ⅱ后用______(填“热水”或“冷水”)洗涤沉淀2-3次,并干燥。其原因是____。
Ⅱ.MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
已知:MnCO3难溶于水和乙醇,受热易分解。
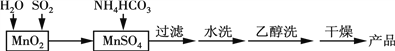
①检验水洗是否完全的方法是______。
②水洗结束后,用乙醇洗涤的目的是______。
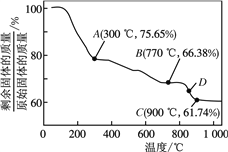
③MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如下图所示。通过计算可知,300℃时,剩余固体中n(Mn)∶n(O)=1:2,即可认为A物质化学式为MnO2,同时测得反应生成了二氧化碳,请写出0~300℃发生反应的化学方程式______。图中点D对应固体的成分为_____(填化学式,并写出计算过程)。
【答案】 +3 B 温度升高,二氧化碳的溶解性变弱,二氧化碳的利用率会降低(或温度升高,Li2CO3的溶解度会降低,利用率会降低; 温度升高,LiHCO3会分解,转化率降低。任写一个都给分) 浆料变得澄清 2LiHCO3![]() Li2CO3+CO2↑+H2O 3 3次循环后,杂质累积,浓度变大析出,产品的纯度变低 热水,温度越高,Li2CO3溶解度越小,热水可减少Li2CO3的溶解 取最后一次洗涤液1~2mL于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。 便于晶体在低温下快速晾干 2MnCO3+O2
Li2CO3+CO2↑+H2O 3 3次循环后,杂质累积,浓度变大析出,产品的纯度变低 热水,温度越高,Li2CO3溶解度越小,热水可减少Li2CO3的溶解 取最后一次洗涤液1~2mL于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。 便于晶体在低温下快速晾干 2MnCO3+O2![]() 2MnO2+2CO2 MnO、Mn3O4
2MnO2+2CO2 MnO、Mn3O4
【解析】(1)化合物中各元素化合价的代数和为零。设LiMnO2中锰元素的化合价为x。(+1)+x+(-2)×2=0,解得x=+3。电池充电时是将电能转化为化学能。(2)Ⅰ.①温度升高,二氧化碳的溶解度减小,二氧化碳的利用率会降低(或温度升高,Li2CO3的溶解度会减小,利用率会降低;或温度升高,LiHCO3会分解,转化率降低。)。判断酸化过程已经结束的明显现象为浆料变得澄清。②因为碳酸氢锂不稳定,受热后会分解,所以蒸发时发生反应的化学方程式为:2LiHCO3![]() Li2CO3+CO2↑+H2O;由母液循环次数对纯度、产率的影响图可知,循环不宜超过3次,3次循环后,杂质累积,浓度变大析出,产品的纯度变低。③为了获得较多高纯Li2CO3,过滤Ⅱ后用热水洗涤沉淀2-3次,并干燥,原因是温度越高,Li2CO3溶解度越小,热水可减少Li2CO3的溶解。Ⅱ.①检验水洗是否完全的方法是取最后一次洗涤液1~2mL于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。②水洗结束后,用乙醇洗涤的目的是因为乙醇具有挥发性,便于晶体在低温下快速晾干。③因为300℃时,剩余固体是MnO2,同时生成二氧化碳,所以反应的化学方程式为:2MnCO3+O2
Li2CO3+CO2↑+H2O;由母液循环次数对纯度、产率的影响图可知,循环不宜超过3次,3次循环后,杂质累积,浓度变大析出,产品的纯度变低。③为了获得较多高纯Li2CO3,过滤Ⅱ后用热水洗涤沉淀2-3次,并干燥,原因是温度越高,Li2CO3溶解度越小,热水可减少Li2CO3的溶解。Ⅱ.①检验水洗是否完全的方法是取最后一次洗涤液1~2mL于试管中,向其中滴加BaCl2溶液,若无白色沉淀生成,则表明已洗涤干净。②水洗结束后,用乙醇洗涤的目的是因为乙醇具有挥发性,便于晶体在低温下快速晾干。③因为300℃时,剩余固体是MnO2,同时生成二氧化碳,所以反应的化学方程式为:2MnCO3+O2![]() 2MnO2+2CO2;设MnCO3的质量为115g,B点剩余固体的质量为115g×66.38%=76.337g,因为Mn元素的质量为55g,则氧元素的质量为76.337g-55g=21.337g,则n(Mn):n(O)=
2MnO2+2CO2;设MnCO3的质量为115g,B点剩余固体的质量为115g×66.38%=76.337g,因为Mn元素的质量为55g,则氧元素的质量为76.337g-55g=21.337g,则n(Mn):n(O)=![]() :
:![]() =3:4,故剩余固体的成分是Mn3O4;D点剩余固体的质量为115g×61.74%=71g,根据锰元素的质量守恒知,m(Mn)=55g,则m(O)=71g-55g=16g,则n(Mn):n(O)=
=3:4,故剩余固体的成分是Mn3O4;D点剩余固体的质量为115g×61.74%=71g,根据锰元素的质量守恒知,m(Mn)=55g,则m(O)=71g-55g=16g,则n(Mn):n(O)=![]() :
:![]() =1:1,故剩余固体的成分是MnO,所以图中点D对应固体的成分为Mn3O4和MnO。
=1:1,故剩余固体的成分是MnO,所以图中点D对应固体的成分为Mn3O4和MnO。

 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体.小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物.
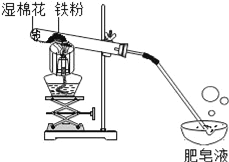
(1)试管尾部放一团湿棉花的目的是____________.
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中.说明生成的气体是____________.
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是__.
【实验探究】
实验操作 | 实验现象及结论 |
______________ | ________________ |
【实验结论】铁和水蒸气反应的化学方程式为__.
【反思与交流】该黑色固体不可能是Fe2O3,理由是__.
【题目】(1)某兴趣小组准备通过锌与稀硫酸反应产生的氢气来测定稀硫酸中溶质的质量分数,装置如下:
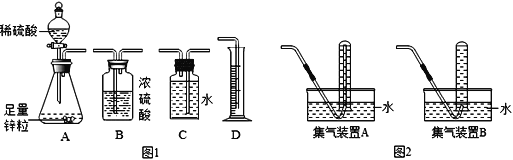
①小明同学用如图1所示装置进行实验,你认为他应该选择的最简易的装置及其连接顺序是:A→______→ D。
②小明若用图2装置收集氢气,应选择集气装置____(填“A”或“B”),为保证测量结果的准确性,收集气体的时机是_________。
a.导管口还没有气泡产生时
b.导管口连续均匀冒出气泡时
c.导管口冒出气泡很多时
③小张同学用如图3所示装置进行了实验:
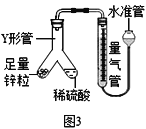
Ⅰ.下列能说明装置气密性良好的是_________。
A.连接仪器后,向水准管中注水,直至左右两边管内形成稳定高度差。
B.向水准管内注水,连接好左侧装置,抬高水准管,左右两边液面始终相平。
Ⅱ.反应完毕后,每间隔1分钟读取气体体积、气体体积逐渐减小,直至体积不变。气体体积逐渐减小的原因是_________________(排除仪器和实验操作的影响因素)。
Ⅲ.若实验中测得稀硫酸的溶质质量分数偏大,下列可能的原因是____________。
a.装置漏气 b.读取数据时水准管的水面高于量气管的水面
c.未待冷却就读取量气管读数
(2)在金属活动性顺序表中,排在前面的金属能把位于后面的金属从它的盐溶液中置换出来,但小明在做金属钠与硫酸铜溶液反应的实验时,却出现了异常现象。
【进行实验】取一块绿豆大小的金属钠,放入盛有20毫升硫酸铜溶液的小烧杯中,发现金属钠浮在液面上不停打转,产生大量气体,烧杯发烫,溶液中出现了蓝色絮状沉淀,一会儿部分沉淀渐渐变黑,将反应后烧杯中的混合物进行过滤,得滤渣和无色滤液。
【提出问题】①生成的气体是什么?
②滤渣的成分是什么?
③无色滤液中的溶质是什么?
【查阅资料】①钠能与水反应生成一种碱,同时放出气体。
②氢氧化铜受热至60~80℃变暗,温度再高分解为相应的金属氧化物(化合价不变)和水。
【实验探究一】 探究生成的气体是什么?
小明将上述实验药品放入锥形瓶中,立即塞上带导管的单孔塞,把气体通入肥皂水中,将燃着的木条靠近飘起的肥皂泡,有爆鸣声。说明生成的气体是___________。
【实验探究二】 探究滤渣的成分是什么?
【猜想假设】滤渣中含有Cu(OH)2和_____________,还可能含有Cu。
【实验验证】
实验步骤 | 实验现象 | 结论 |
取少量滤渣,向其中加入足量的稀硫酸 | ____________________ | 滤渣中没有Cu |
【实验结论】通过实验,小明同学得出结论:钠加入到硫酸铜溶液中会先与水反应,生成物再与硫酸铜反应生成氢氧化铜。请写出上述发生的两个反应的化学方程式______________ ,________________。
【实验探究三】探究无色滤液的溶质是什么?
【猜想假设】猜想① Na2SO4 , 猜想②________________。
【实验验证】
实验步骤 | 实验现象 | 结论 |
取少量无色滤液,向其中加入__________ | 无明显变化 | 猜想①成立 |
【反思交流】钠加入硫酸铜溶液中出现黑色物质的可能原因是(用化学方程式表示)_________。