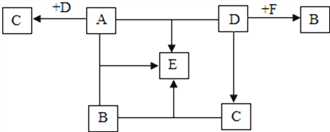
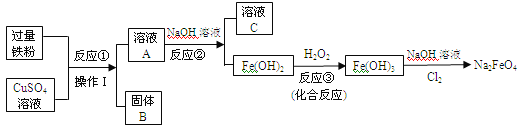
��Ŀ����
����Ŀ���絼���Ǻ����������Һ����������С��������.��Һ�絼�ʴ�С�仯���Է�ӳ�������Һ������Ũ�ȵĴ�С�仯����ͼ����100mLһ����������������Ba(OH)2��Һ�зֱ�μ�ϡH2SO4��Һ��ϡNa2SO4��Һ�Ĺ�������Һ�絼����ʱ��仯ͼ���ش��������⡣
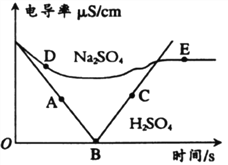
(1)д��Ba(OH)2��H2SO4��Ӧ�Ļ�ѧ����ʽ_______________��
(2)����ͼ��A-E�����Ӧ����Һ�еμӷ�̪������Һ�ʺ�ɫ����____________��
(3) D-��E�ķ�Ӧ�����У���Һ����Ŀʼ�����������___________��
(4)���ⶨ��B��ʱ����ϡH2SO4��Һ50mL���ҹ��˺���Һ����Ϊ147. 67g�������ԭBa(OH)2��Һ��������������__________(д��������̣�����ϡ��Һ���ܶȶ��ɿ���1g��mL-1)��
���𰸡� (1)Ba(OH)2+H2SO4=BaSO4��+2H2O (2)A (3)Na+ (4)1.71%
�⣺B��ʱ�������ᱵ����������=50mL![]() 1g��mL-1+100mL
1g��mL-1+100mL![]() 1g��mL-1-147. 67g=2.33g�� ��μӷ�Ӧ��������������Ϊx����
1g��mL-1-147. 67g=2.33g�� ��μӷ�Ӧ��������������Ϊx����
Ba(OH)2+H2SO4=BaSO4��+2H2O
171 233
x 2.33g
![]()
x=1.71g��
ԭBa(OH)2��Һ��������������=![]() ��
��
��������(1)Ba(OH)2��H2SO4��Ӧ�������ᱵ������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Ba(OH)2+H2SO4=BaSO4��+2H2O��(2)B��ʱ����ǡ����ȫ��Ӧ����Һ�����ԣ���̪Ϊ��ɫ���ʻ��Һ�����ɫ��B��ǰ�����»��Ĺ����У�H+��OH-��ϳ�H2O��������������������Һ�ʼ��ԣ��ʻ��Һ��ʺ�ɫ��B�����Һ�絼��������������Һ��H+����������Һ�����ԣ���̪Ϊ��ɫ���ʻ��Һ�����ɫ��(3)D��E�ķ�Ӧ��������Ba(OH)2��Na2SO4��Ӧ�������ᱵ�������������ƣ���ǡ����ȫ��Ӧ������Na2SO4��Һ�IJ��ϼ��룬����Һ��ֻ��Na+��Ŀһֱ������(4)�⣺B��ʱ�������ᱵ����������=50mL![]() 1g��mL-1+100mL
1g��mL-1+100mL![]() 1g��mL-1-147. 67g=2.33g�� ��μӷ�Ӧ��������������Ϊx����
1g��mL-1-147. 67g=2.33g�� ��μӷ�Ӧ��������������Ϊx����
Ba(OH)2+H2SO4=BaSO4��+2H2O
171 233
x 2.33g
![]()
x=1.71g��
ԭBa(OH)2��Һ��������������=![]() ��
��

 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�����Ŀ��������û����������ʱ������ˮ��������Ӧ���������£�����ˮ�����ܷ�Ӧ����һ�ֳ��������������һ�����壮С���ܺ��棬�������ʵ��̽��������ˮ������Ӧ��IJ��
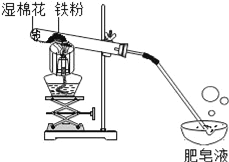
��1���Թ�β����һ��ʪ����Ŀ����____________��
��2��̽�����ɵ�������ʲô��
��ȼ�ŵ�ľ�����������ݣ��б��������Ժ��з�����Ʈ�����У�˵�����ɵ�������____________��
��3��̽���Թ���ʣ�����ɷ���ʲô��
���������ϡ�
�������������� | FeO | Fe2O3 | Fe3O4 |
��ɫ��״̬ | ��ɫ��ĩ | ����ɫ��ĩ | ��ɫ���� |
�ܷ������� | �� | �� | �� |
��������֤���Թ���ʣ�����Ϊ��ɫ����ȫ��������������
����������衿����һ��ʣ�������Fe��Fe3O4���������ʣ�������__��
��ʵ��̽����
ʵ����� | ʵ�������� |
______________ | ________________ |
��ʵ����ۡ�����ˮ������Ӧ�Ļ�ѧ����ʽΪ__��
����˼�뽻�����ú�ɫ���岻������Fe2O3��������__��
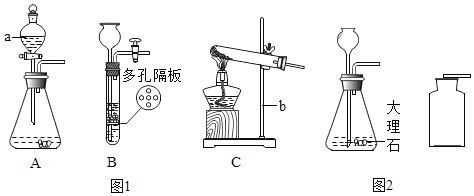
����Ŀ����1��ij��ȤС����ͨ��п��ϡ���ᷴӦ�������������ⶨϡ���������ʵ�����������װ�����£�
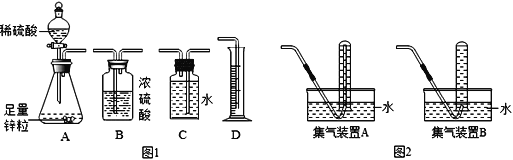
��С��ͬѧ����ͼ1��ʾװ�ý���ʵ�飬����Ϊ��Ӧ��ѡ����������װ�ü�������˳���ǣ�A��______�� D��
��С������ͼ2װ���ռ�������Ӧѡ����װ��____���A����B������Ϊ��֤���������ȷ�ԣ��ռ������ʱ����_________��
a.���ܿڻ�û�����ݲ���ʱ
b.���ܿ���������ð������ʱ
c.���ܿ�ð�����ݺܶ�ʱ
��С��ͬѧ����ͼ3��ʾװ�ý�����ʵ�飺
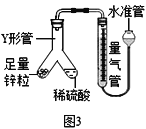
��������˵��װ�����������õ���_________��
A.������������ˮ����עˮ��ֱ���������߹����γ��ȶ��߶Ȳ
B.��ˮ����עˮ�����Ӻ����װ�ã�̧��ˮ�ܣ���������Һ��ʼ����ƽ��
��Ӧ��Ϻ�ÿ���1���Ӷ�ȡ������������������С��ֱ��������䡣���������С��ԭ����_________________���ų�������ʵ�������Ӱ�����أ���
����ʵ���в��ϡ�����������������ƫ�����п��ܵ�ԭ����____________��
a.װ��©�� b.��ȡ����ʱˮ�ܵ�ˮ����������ܵ�ˮ��
c.δ����ȴ�Ͷ�ȡ�����ܶ���
��2���ڽ������˳����У�����ǰ��Ľ����ܰ�λ�ں���Ľ�������������Һ���û���������С������������������ͭ��Һ��Ӧ��ʵ��ʱ��ȴ�������쳣����
������ʵ�顿ȡһ���̶���С�Ľ����ƣ�����ʢ��20��������ͭ��Һ��С�ձ��У����ֽ����Ƹ���Һ���ϲ�ͣ��ת�������������壬�ձ����̣���Һ�г�������ɫ��״������һ������ֳ���������ڣ�����Ӧ���ձ��еĻ������й��ˣ�����������ɫ��Һ��
��������⡿�����ɵ�������ʲô��
�������ijɷ���ʲô��
����ɫ��Һ�е�������ʲô��
���������ϡ���������ˮ��Ӧ����һ�ּͬʱ�ų����塣
��������ͭ������60��80��䰵���¶��ٸ߷ֽ�Ϊ��Ӧ�Ľ���������(���ϼ۲���)��ˮ��
��ʵ��̽��һ�� ̽�����ɵ�������ʲô��
С��������ʵ��ҩƷ������ƿ�У��������ϴ����ܵĵ�������������ͨ�����ˮ�У���ȼ�ŵ�ľ������Ʈ��ķ����ݣ��б�������˵�����ɵ�������___________��
��ʵ��̽������ ̽�������ijɷ���ʲô��
��������衿�����к���Cu(OH)2��_____________�������ܺ���Cu��
��ʵ����֤��
ʵ�鲽�� | ʵ������ | ���� |
ȡ���������������м���������ϡ���� | ____________________ | ������û��Cu |
��ʵ����ۡ�ͨ��ʵ�飬С��ͬѧ�ó����ۣ��Ƽ��뵽����ͭ��Һ�л�����ˮ��Ӧ����������������ͭ��Ӧ����������ͭ����д������������������Ӧ�Ļ�ѧ����ʽ______________ ��________________��
��ʵ��̽������̽����ɫ��Һ��������ʲô��
��������衿����� Na2SO4 �� �����________________��
��ʵ����֤��
ʵ�鲽�� | ʵ������ | ���� |
ȡ������ɫ��Һ�������м���__________ | �����Ա仯 | ����ٳ��� |
����˼�������Ƽ�������ͭ��Һ�г��ֺ�ɫ���ʵĿ���ԭ���ǣ��û�ѧ����ʽ��ʾ��_________��