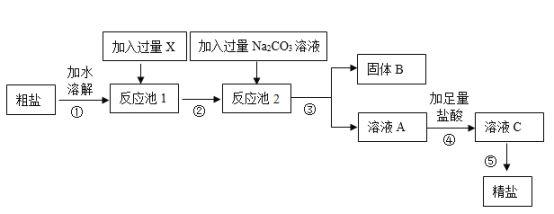
题目内容
【题目】(1) 某无色气体可能含有H2、CO、CH4中的种或几种,依次进行下列实验(假设每步反应或吸收均完全):
①无色气体在足量的氧气中充分燃烧;
②将生成的气体通过盛有浓硫酸的洗气瓶吸收气体中的水蒸气,装置质量增加10.8g;
③再将剩余气体通过盛有足量Ca (OH)2溶液的洗气瓶,装置质量增加13.2g.则该气体的组成情况可能有_____________种 。
(2)等质量的NaCl、KCl、CaCl2,分别与等质量、等质量分数的硝酸银溶液反应,生成沉淀质量(用各物质化学式表示)的大小关系有以下猜测①NaCl= KCl=CaCl2②CaCl2 =NaCl> KCl③CaCl2> NaCl= KCl④NaCl >CaCl2> KCl,其中正确的是___________。
【答案】3 ①②
【解析】
浓硫酸吸收燃烧生成的水而氢氧化钙溶液用于吸收燃烧生成的二氧化碳,浓硫酸质量与氢氧化钠溶液的质量都增加,说明燃烧既生成了水又生成了二氧化碳,结合可燃物完全燃烧的规律,可判断混合气体中含C、H元素。
(1)由生成的气体通过浓硫酸,装置质量增加10.8g,可判断燃烧生成了10.8g水,说明混合气体中含氢元素,且氢元素质量=10.8g×![]() ×100%=1.2g;
×100%=1.2g;
由气体通过氢氧化钙溶液,装置质量增加13.2g,可判断燃烧生成了13.2g二氧化碳,说明混合气体中含碳元素,且碳元素质量=13.2g×![]() ×100%=3.6g;
×100%=3.6g;
计算可知混合气体中C、H元素质量比=3.6g:1.2g=3:1,而甲烷气体中C、H元素质量比=12:(1×4)=3:1,因此可判断混合气体可能只有甲烷;也可能只含有CO和H2;也可能是甲烷、氢气、一氧化碳同时存在,不可能含有甲烷和另外任何一种气体,因此有三种可能。
(2)氯化钠中氯元素的质量分数为![]() ×100%≈61%;氯化钾中氯元素的质量分数为
×100%≈61%;氯化钾中氯元素的质量分数为![]() ×100%≈48%;氯化钙中氯元素的质量分数为
×100%≈48%;氯化钙中氯元素的质量分数为![]() ×100%≈64%;由于加入的NaCl、KCl、CaCl2质量相等,所以对应的氯元素质量最多的是氯化钙,其次是氯化钠最后是氯化钾。由于加入的硝酸银质量不确定,如果硝酸银过量,则三者得到的沉淀的质量顺序为CaCl2> NaCl> KCl。如果量很少,连氯化钾都不足以完全反应,则生成的沉淀的质量为NaCl=KCl=CaCl2;加入的硝酸银多一些,只能完全反应氯化钾,则生成的沉淀质量CaCl2=NaCl>KCl;如果氯化钠也完全反应,而氯化钙没有完全反应,则生成的沉淀质量CaCl2=NaCl>KCl。故选①②。
×100%≈64%;由于加入的NaCl、KCl、CaCl2质量相等,所以对应的氯元素质量最多的是氯化钙,其次是氯化钠最后是氯化钾。由于加入的硝酸银质量不确定,如果硝酸银过量,则三者得到的沉淀的质量顺序为CaCl2> NaCl> KCl。如果量很少,连氯化钾都不足以完全反应,则生成的沉淀的质量为NaCl=KCl=CaCl2;加入的硝酸银多一些,只能完全反应氯化钾,则生成的沉淀质量CaCl2=NaCl>KCl;如果氯化钠也完全反应,而氯化钙没有完全反应,则生成的沉淀质量CaCl2=NaCl>KCl。故选①②。

【题目】学习了生活中常见的盐后,化学实验活动课上,互助合作小组同学们做了如下图所示的三组实验。实验结束后,所有同学将A、B、C三支试管中的废液全部倒入一个干净的大烧杯中,静置一段时间,发现杯底有白色沉底,上层溶液呈红色 。
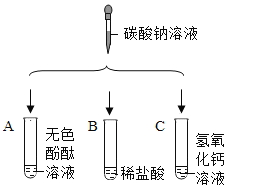
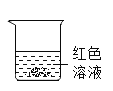
(提出问题)小明同学提出,大烧杯的上层溶液中除了含有水和酚酞外还含有哪些粒子?
(查阅资料) CaCl2溶液呈中性。
(猜想假设)经小组讨论后,同学们作了如下猜想:
①Na+、Cl- 、CO32-
②Na+、Cl-、OH-
③Na+、Cl-、 CO32-、OH-
④Na+、Cl-、Ca2+、OH-
⑤Na+、Ca2+、 CI-、CO32-
小明认为猜想______________不正确,理由是_______________。
(进行实验)同学们对可能存在的离子进行激烈的讨论,一组同学设计了如下方案,对可能存在的粒子进行探究。
实验操作 | 实验现象 | 实验结论 |
取废液少许于试管中,向其中滴加过量的CaCl2溶液 | ____________ | 溶液中一定含有CO32- |
试管中上层清液仍为红色 | 溶液中一定含有_____(写离子符号) |
实验中加入过量的CaCl2溶液的目的是___________________。
(得出结论)猜想___________________正确。
(反思提升)探究废液成分时,需先分析出一定存在和一定不存在的离子,然后再对________进行检验。
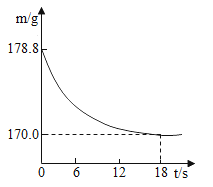
(拓展延伸)某纯碱样品中含有少量氯化钠杂质。称取该样品22. 8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。计算所得溶液中溶质的质量分数。(写出解题过程,计算结果精确到0. 1%)________________________