题目内容
【题目】水是生命之源,通过化学学习,我们进一步认识到水的重要作用。
(1)用加了洗涤剂的水能洗掉餐具上的油污,这是利用了洗涤剂的_________作用。
(2)自然界的水常常遭到人为污染。污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,这里的“氮和磷”是指 ___________(填序号)。
A 元素 B 原子 C 离子 D 分子
(3)下列说法正确的是_______(填序号)。
A 可通过过滤的方法除去受污染水中的可溶性有毒物质
B 水能溶解很多物质,是一种最常见的溶剂
C 水可以灭火,是因为水可以降低可燃物的着火点
D 电解水实验证明了水是由氢元素和氧元素组成的
(4)利用锂与水的反应可制成锂水电池,作为潜艇的储备电源。已知锂与水反应生成一种碱和一种难溶性气体,请写出该反应的化学反应方程式_______________________________ 。
【答案】乳化 A BD ![]()
【解析】
(1)洗涤剂的乳化作用可将油分散成无数细小的液滴,而不聚成大的油珠,从而随着水的流动而被冲走。
(2)“氮和磷”是指元素,元素即具有相同核电荷数一类原子的总称。
(3)A、可通过过滤的方法除去受污染水中的不溶性有物质,故错误;
B、水能溶解很多物质,是一种最常见的溶剂,故正确;
C、水可以灭火,是因为水可以降低温度至可燃物的着火点以下,故错误;
D、电解水实验证明了水是由氢元素和氧元素组成的,故正确。
故选BD。
(4)锂与水反应生成氢氧化锂和氢气,其化学方程式为![]() 。
。

【题目】将一小块银白色的金属钾放置在空气中会发生下列变化:
![]()
(提出问题)常温下钾与氧气反应产物有哪些?
(查阅资料)钾的氧化物,除氧化钾(K2O)外还有过氧化钾(K2O2),氧化钾与过氧化钾都能与水发生反应,化学方程式为![]() ;
;![]() 。
。
(猜想一)常温下钾与氧气反应的产物。
猜想1:K2O;
猜想2:K2O2;
猜想3:________________。
(实验探究一)
实验操作 | 实验现象 | 实验结论 |
取少量钾的氧化物加入足量蒸馏水 | ________________ | 猜想1正确 |
(继续探究)钾在空气中放置一段时间得到白色固体的成分。
(猜想二)猜想1:K2CO3;
猜想2:K2CO3和KOH。
(实验探究二)
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体加入足量_______________________ | 产生白色沉淀 | 白色固体成分为K2CO3和KOH |
②过滤,取少量滤液加入________________________ | _______ |
(实验反思)
类比氧化铁与盐酸的反应,写出氧化钾与盐酸反应的化学方程式:________________。
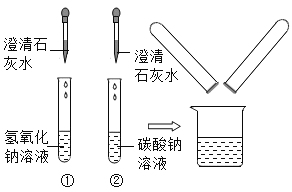
【题目】在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如下图所示的实验。
(1)实验中,无明显变化的试管是___________(填编号)。
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究。
(提出问题)滤液中除水外还含有哪些物质?
(猜想)小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是 ______________________ (写一种猜想)。
(讨论)你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由:___________。
(实验设计)设计一个简单的实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取样于试管中:______________ | 试管中出现白色浑浊 | 你的猜想正确 |
(实验分析)小亮同学针对自己的猜想进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
你认为小亮同学对实验结果判断是否正确?请说明理由。____________________。
(反思拓展)
①在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑__________________________;
②通过以上探究,你认为应怎样处理上述实验后的废液才能倒入下水道?_____________________。
【题目】在20℃环境中,制取干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应,设计如下探究实验。
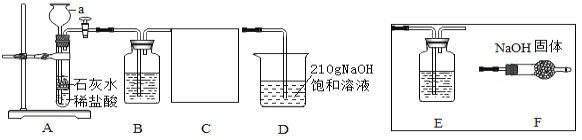
(查阅资料)(1)碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
(2)20℃,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示
物质 | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 110 | 21.8 | 9.6 |
(定性探究)(1)仪器a的名称是____________________;
(2)装置B中盛有 NaHCO3溶液,目的是吸收装置A中挥发出的HCl气体,写出B中发生反应的化学方程式:_______________;
(3)装置C的作用是______________,选择________(选填E、F)达到实验目的;
(4)在实验过程中装置D中观察到______________,说明CO2和NaOH溶液能发生反应。
(定量计算)
(5)装置D中NaOH全部转化成Na2CO3时,理论上最多可以生成Na2CO3多少克____________?
(6)当向装置D中通入足量的CO2时,可以将NaOH全部转化为NaHCO3,实验过程中会析出的NaHCO3质量___________g(不考虑结晶水)。