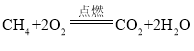题目内容
【题目】现有一包粗盐,主要成分是氯化钠,其中含少量的硫酸钠、氯化钙和沙子,小轩设计了如图工艺流程,制得精盐。
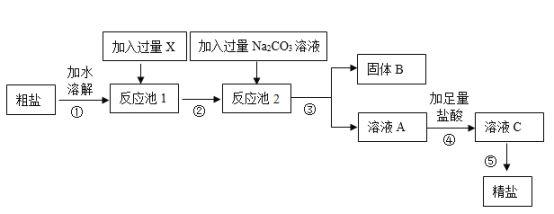
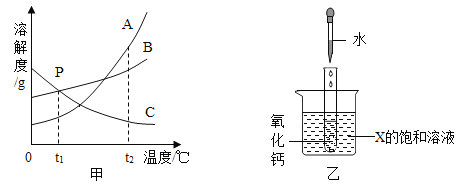
(1)在①-⑤的操作中,属于蒸发操作的是______(填序号),蒸发操作中用于提供热源的仪器是______。
(2)向反应池1中加过量的x是_____溶液(填序号)。
a KOH b NaOH c Ba(OH)2 d Ca(OH)2
(3)固体B中含有的物质有_______(写物质名称,至少写两种)。
(4)第④步加足量盐酸的目的是________。
(5)写出反应池2中所发生的化学方程式:①____、②______。
【答案】⑤ 酒精灯 c 硫酸钡、碳酸钡(或碳酸钙) 除去过量的NaOH和Na2CO3 Na2CO3+Ba(OH)2=BaCO3↓+2NaOH Na2CO3+CaCl2=CaCO3↓+2NaCl
【解析】
(1)操作⑤是从溶液中获取晶体,即蒸发操作;蒸发操作中用于提供热源的仪器是酒精灯;故填:⑤;酒精灯;
(2)加入试剂x是为了除去硫酸钠,所以加入的是氢氧化钡溶液,硫酸钠和氢氧化钡反应生成硫酸钡沉淀和氢氧化钠;故填:c;
(3)先加入过量的氢氧化钡溶液除去硫酸钠,二者反应生成硫酸钡沉淀和氢氧化钠;然后再加入过量的碳酸钠,碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,所以过滤后得到的固体B中含有硫酸钡、碳酸钡和碳酸钙三种物质;故填:硫酸钡、碳酸钡(或碳酸钙);
(4)在第④步操作中,向滤液中滴加足量盐酸的目的是除去加入的过量的NaOH和Na2CO3;故填:除去过量的NaOH和Na2CO3;
(5)反应池2中碳酸钠与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,故填:Na2CO3+Ba(OH)2=BaCO3↓+2NaOH;Na2CO3+CaCl2=CaCO3↓+2NaCl。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】将一小块银白色的金属钾放置在空气中会发生下列变化:
![]()
(提出问题)常温下钾与氧气反应产物有哪些?
(查阅资料)钾的氧化物,除氧化钾(K2O)外还有过氧化钾(K2O2),氧化钾与过氧化钾都能与水发生反应,化学方程式为![]() ;
;![]() 。
。
(猜想一)常温下钾与氧气反应的产物。
猜想1:K2O;
猜想2:K2O2;
猜想3:________________。
(实验探究一)
实验操作 | 实验现象 | 实验结论 |
取少量钾的氧化物加入足量蒸馏水 | ________________ | 猜想1正确 |
(继续探究)钾在空气中放置一段时间得到白色固体的成分。
(猜想二)猜想1:K2CO3;
猜想2:K2CO3和KOH。
(实验探究二)
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体加入足量_______________________ | 产生白色沉淀 | 白色固体成分为K2CO3和KOH |
②过滤,取少量滤液加入________________________ | _______ |
(实验反思)
类比氧化铁与盐酸的反应,写出氧化钾与盐酸反应的化学方程式:________________。