题目内容
【题目】如图为A、B、C三种物质的溶解度曲线,回答下列问题。
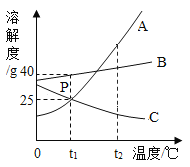
(1)当温度在t1℃<t<t2℃之间时,A物质与B物质_____ (填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
(2) t1℃时,若要将210克B物质的饱和溶液稀释成溶质质量分数为10%的溶液,需要加水的质量为_____。
(3)分别将A、B、C的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系是_____。
【答案】能 390g B>A>C
【解析】
(1)当温度在t1℃<t<t2℃之间时,A、B物质的溶解度在某个温度时相等,所以A物质与B物质能配制溶质质量分数相同的饱和溶液;
(2)t1℃时,若要将210克B物质的饱和溶液稀释成溶质质量分数为10%的溶液,需要加水的质量为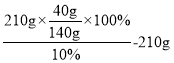 =390g;
=390g;
(3)t1℃时,B物质的溶解度最大,A、C物质的溶解度相等,降低温度,A、B物质的溶解度减小,C物质的溶解度增大,所以分别将A、B、C的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系是:B>A>C;

【题目】下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是( )
选项 | 实验目的 | 实验过程 |
① | 证明变质 | 取少量溶液,滴加足量盐酸,将生成的气体通入澄清石灰水 |
② | 确定成分 | 取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞溶液 |
③ | 测定纯度 | 取一定量溶液,加入盐酸,用氢氧化钠固体吸收生成的气体,称量 |
④ | 除去杂质 | 取溶液,滴加石灰水至恰好完全反应,过滤 |
A.②③B.①③C.②④D.①④
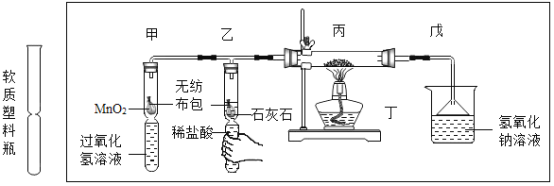
【题目】碳还原氧化铜的实验如图1所示。写出该反应的化学方程式:________。
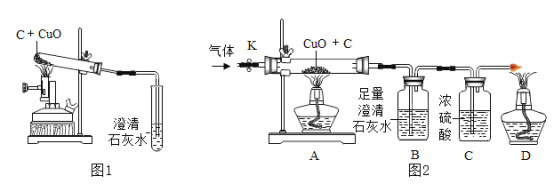
[提出问题]碳燃烧时可能生成CO2也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]猜想①:CO。猜想②:CO2。猜想③:________。
[设计方案]实验装置如图2(浓硫酸具有吸水作用)。打开K,缓缓通人干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
(1)实验时A处的现象是_______。
(2)若B中无明显实验现象,D处气体能被点燃,则猜想______(填序号)成立。
方案二:从定量计算角度判断
取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(玻璃管+固体) | m1 | m2 |
B +C(广口瓶+混合液) | m3 | m4 |
(3)若猜想②成立,则理论上(m4-m3)______(填“<”“=”或“>”)(m1-m2)。
(4)若猜想③成立且CuO全部转化成Cu,则参加反应的碳的质量m的取值范围是_____。
[交流反思]实验开始前缓缓通入氮气的目的是_______。
【题目】镀铬金属既漂亮又耐腐蚀,为了解金属铬的相关性质同学们进行了如下探究活动。
[查阅资料]
资料1:铬是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。
资料2:铬在发生置换反应时生成Cr2+,含有Cr2+的溶液常显蓝色。
[实验药品]铝片、铬片、铜片、稀硫酸、稀盐酸、CrSO4 溶液。
[实验过程]
(1)彬彬同学取大小相同的铝片、铬片和铜片,准备浸入到盛有相同质量分数的稀硫酸的三根试管中观察现象,三种金属片放入稀硫酸前要进行预处理是_____。
记录现象如下:
试管1 | 试管2 | 试管3 | |
实验现象 | 金属片表面产生气泡缓慢,溶液逐渐变蓝色 | 金属片表面产生气泡较快 | |
实验结论 | 三种金属的金属活动性由强到弱的顺序为_____。( 填元素符号) | ||
写出试管1中发生反应的化学方程式_____。
(2)明明从上面给定的实验药品中选了三种药品进行实验,也得出了上述三种金属的活动性强弱,则他选用的三种实验药品是_____,实验中发生反应的化学方程式为_____。
[学以致用]
(3)彬彬同学了解到某电镀厂废水中含有AgNO3、Cu(NO3)2 和Cr(NO3)2,为了从中回收贵重金属银和一种盐晶体,他设计如下图实验流程:
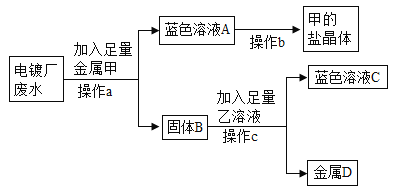
请回答:操作a加入足量的金属甲为_____,反应前固体B质量_____(填“大于”、 “小于”或“等于”)反应后固体D的质量。
[知识拓展]
(4)工业上可利用“铝热反应”来冶炼铬,其原理是在高温下用铝将铬从其氧化物(Cr2O)中置换出来。若要制得780kg铬,理论上至少需要铝的质量是多少_____?