题目内容
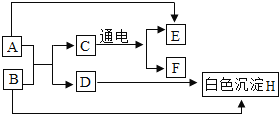
【题目】A~G是初中化学常见物质,各物质转化关系如图所示(“→”表示转化关系,“﹣”表示互相反应,反应条件、部分反应物和生成物已省略),其中D和F组成元素相同。
(1)物质A的化学式为_____。
(2)反应③的化学方程式为_____。
(3)图中的分解反应有_____(填序号)。
(4)根据反应②,B物质可以在实验室或生活中作_____。
【答案】CaCO3 CO2+H2O=H2CO3 ①⑤ 干燥剂
【解析】
根据A~G是初中化学常见物质,其中D和F组成元素相同,E在反应前后没有变化,所以E是催化剂,F反应会生成D和G,过氧化氢在二氧化锰的催化作用下分解生成水和氧气,所以F是过氧化氢溶液,E是二氧化锰,D是水,G是氧气,A分解生成B、C会与水反应,所以A是碳酸钙,C会转化成氧气,所以C是二氧化碳,B是氧化钙。
(1)由分析可知,A为碳酸钙,其化学式为CaCO3,故填CaCO3。
(2)由分析可知,D为水,C为二氧化碳,所以反应③是水和二氧化碳反应生成碳酸,故反应的化学方程式写为:CO2+H2O=H2CO3。
(3)过氧化氢分解能生成水和氧气,碳酸钙高温分解能生成氧化钙和二氧化碳,所以图中的分解反应有①⑤,故填①⑤。
(4)由分析可知,B为氧化钙,D为水,根据反应②,物质B(氧化钙)可以在实验室或生活中作干燥剂,故填干燥剂。

 阅读快车系列答案
阅读快车系列答案【题目】请根据下列装置回答问题:
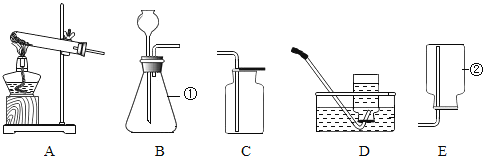
(1)写出①、②的仪器名称:①_____;②_____________。
(2)用字母填写下表
制取的气体 | 发生装置 | 收集装置 |
CO2 | _________ | _________ |
少量的O2 | _________ | D或_________ |
较多的O2 | _________ |
(3)实验室用B装置制取氧气的化学方程式为__________,用D装置收集O2的操作中,当O2收满后接下来要进行的操作是____________。
(4)实验室可用无水醋酸钠固体与碱石灰固体在加热的情况下制CH4,用此法来制取CH4,应选用的气体发生装置是__________(填字母,下同),可选用的气体收集装置是___________。
【题目】在食盐中加入适量的碘酸钾(KIO3),可预防碘缺乏病。
(1)人类膳食中缺碘易患_________
A 甲状腺肿大 B 贫血 C 骨质疏松症 D 软骨病
(2)某兴趣小组的同学,欲检测一袋食盐是否为加碘食盐,他们查阅资料得知,加碘食盐中的KIO3在酸性条件下能与KI溶液发生反应,生成碘(I2),淀粉遇I2变蓝色。现提供下列试剂和生活中常见的物质:
①KI溶液;②纯碱:③米汤;④白糖;⑤白酒:⑥白醋,该小组同学进行实验必须选用的试剂和物质是_______________
A ①③④ B ①③⑥ C ②④⑥ D ①④⑤
(3)该小组同学仔细阅读加碘食盐包装袋上的说明后,提出问题并与其他同学讨论,继续进行探究。
问题一:食盐是比较稳定的,而说明中强调“防热”,是否因为受热会造成碘的损失?
(实验一)探究温度对碘损失率的影响
老师指导他们将一定浓度的碘酸钾溶液分成5等份,在不同温度下加热十分钟后,用硫代硫酸
钠标准溶液测定碘酸钾溶液的浓度,计算碘损失率并记录如表:
温度 | 30℃水浴 | 50℃水浴 | 80℃水浴 | 100℃水浴 | 煮沸 |
碘损失率(%) | 0 | 0.3 | 0.67 | 1 | 5.56 |
①分析上表可得出的结论是_____________________________________
②人们常说:“炒菜时要后放碘盐,以免碘的损失。”这里的“碘”指的是____(填“碘单质”、“碘 元素”或“碘原子”)。
问题二:炒菜时加醋对碘的损失率是否也有影响?
(实验二)探究酸碱度对碘损失率的影响
③此组对照实验,要控制在加热的时间和温度、碘酸钾溶液的浓度和______均相同,溶液的酸碱度不同的条件下进行。
④实验需要调节溶液的酸碱性,下列物质不能选用的是_______(填字母)。
A 氢氧化钠 B 纯碱粉末 C 食盐晶体 D 稀盐酸
(4)碘酸钾中碘元素的质量分数为______。我国规定,食盐中加碘的含量为每千克食盐含腆0.035克,相当于每千克食盐含碘酸钾_____克。(精确到小数点后二位)
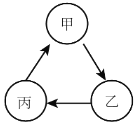
【题目】常温下,下表物质符合图中转化关系的是( )
选项 | 甲 | 乙 | 丙 | 转化关系图 |
A | CaCO3 | Ca(OH)2 | CaCl2 |
|
B | CuO | H2O | O2 | |
C | NaCl | NaNO3 | NaOH | |
D | CO2 | H2O | H2CO3 |
A.AB.BC.CD.D