题目内容
【题目】金属与生活息息相关,认识金属的性质对我们至关重要,认真阅读,回答问题。
材料一:镓(Ga)是灰蓝色或银白色的金属,熔点很低,沸点很高。其化学性质与铝相似,能与氧气在加热时反应。金属镓广泛应用于半导体材料,光电子工业和微波通讯工业等领域。镓的原子结构示意图如图所示。
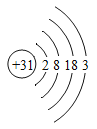
(1)镓的物理性质有_________________________。
(2)写出镓与氧气反应的化学方程式___________________________。
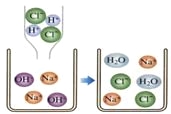
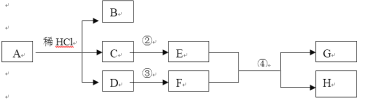
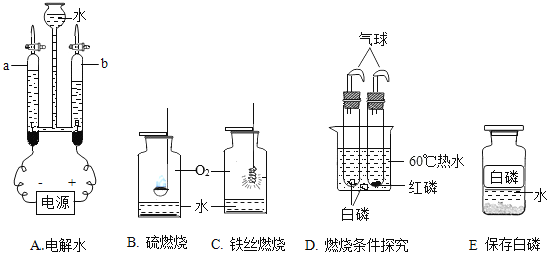
材料二:金属活动顺序在工农业生产和科学研究中有重要应用。现有铜、银、锌三种金属,某小组同学为了探究这三种金属的活动性,设计了以下实验:

(3)试管A中反应的化学方程式是_________________________,由实验A、B、C可推断出Ag、Zn、Cu三种金属的活动性由强到弱的顺序为_____________________。
(4)向C完全反应后的试管里加入一定质量的锌粒(如D试管)。D试管中一定会发生的反应是的化学方程式是________________________。
【答案】灰蓝色或银白色金属,熔点很低,沸点很高 4Ga+3O2![]() 2Ga2O3 Zn+2HCl═ZnCl2+H2↑ Zn>Cu>Ag Zn+2AgNO3=2Ag+Zn(NO3)2
2Ga2O3 Zn+2HCl═ZnCl2+H2↑ Zn>Cu>Ag Zn+2AgNO3=2Ag+Zn(NO3)2
【解析】
(1)镓的物理性质有灰蓝色或银白色金属,熔点很低,沸点很高。故填:灰蓝色或银白色金属,熔点很低,沸点很高。
(2)镓的化学性质与铝相似,能与氧气在加热时反应,反应的方程式为:4Ga+3O2![]() 2Ga2O3,故填:4Ga+3O2
2Ga2O3,故填:4Ga+3O2![]() 2Ga2O3。
2Ga2O3。
(3)试管A中锌和稀盐酸反应生成氯化锌和氢气,反应的化学方程式是:Zn+2HCl═ZnCl2+H2↑;
C中铜和硝酸银反应生成硝酸铜和银,实验现象是铜片表面附着一层银白色固体,溶液由无色变成蓝色;
由实验A、B、C可推断出Ag、Zn、Cu三种金属的活动性由强到弱的顺序为Zn>Cu>Ag.
故填:Zn+2HCl═ZnCl2+H2↑;铜片表面附着一层银白色固体,溶液由无色变成蓝色;Zn>Cu>Ag.
(4)C完全反应后的试管里的溶质有硝酸银和硝酸铜,加入一定质量的锌片时,锌先和硝酸银反应生成硝酸锌和银,如果锌足量,再和硝酸铜反应,因此D试管中一定会发生的反应是:Zn+2AgNO3=Zn(NO3)2+2Ag.
故填:Zn+2AgNO3=Zn(NO3)2+2Ag.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案