题目内容
【题目】为了增强导电性,实验室用溶质质量分数为![]() 的氢氧化钠溶液进行水的电解实验。
的氢氧化钠溶液进行水的电解实验。
实验一:配制![]() 溶质质量分数为
溶质质量分数为![]() 的氢氧化钠溶液。
的氢氧化钠溶液。
①将烧杯放入电子天平上称量时,先要进行_______操作。再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出____g数据为止。
②实际配制的溶液中溶质的质量分数小于![]() ,其原因不可能是____。
,其原因不可能是____。
A氢氧化钠固体不纯 B固体倒入烧杯时洒落到电子天平上
C配制时所用烧杯内残留部分水 D倒入试剂瓶时有少量液体溅出
实验二:水的电解实验
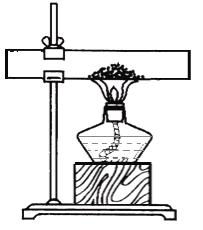
③用如图装置进行水的电解实验
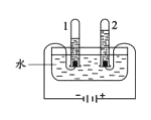
Ⅰ.如图试管1得到的气体是_____。该反应的方程式为__________________。
Ⅱ.电解水实验证明了水由_________组成。
电解水过程中保持不变的微粒是_____________(填写微粒名称)。
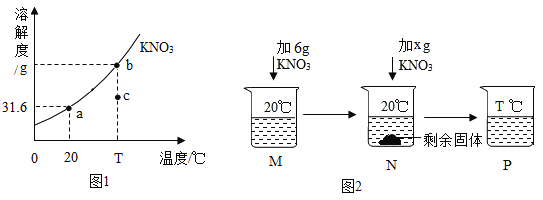
Ⅲ.![]() 时,将等质量的甲、乙固体,分别加入到盛有
时,将等质量的甲、乙固体,分别加入到盛有![]() 水的烧杯中,充分搅拌后现象如图1,加热到
水的烧杯中,充分搅拌后现象如图1,加热到![]() 时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
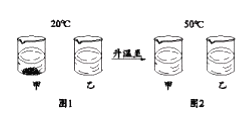
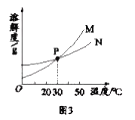
下列说法正确的是______(填字母序号)。
A图3中N表示的是甲的溶解度曲线 B图2中甲、乙溶液的溶质质量分数相等
C图2中甲溶液是不饱和溶液 D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数
【答案】去皮 5 D ![]() 或氢气
或氢气 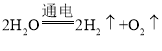 H、O或氢元素和氧元素 氢原子和氧原子 BC
H、O或氢元素和氧元素 氢原子和氧原子 BC
【解析】
实验一:①溶质质量=溶液质量×溶质的质量分数,配制100g质量分数为5%的氢氧化钠溶液,所需的氢氧化钠质量为100g×5%=5g,将烧杯放入电子天平上称量时,先要进行去皮操作,再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出5g数据为止;
②实际配制的溶液中溶质的质量分数小于5%,可能是氢氧化钠固体偏小了,也可能是水的体积偏大了,所以
A.氢氧化钠固体不纯,氢氧化钠实际质量偏小,溶质质量分数偏小,故正确;
B.固体倒入烧杯时洒落到电子天平上,溶解在烧杯中的氢氧化钠质量偏小,溶质质量分数偏小,故正确;
C.配制时所用烧杯内残留部分水,溶剂质量偏大,溶质质量分数小,故正确;
D.倒入试剂瓶时有少量液体溅出,不会影响质量分数的大小,故错误。
故选:D;
实验二:I、水在通电的条件下生成氢气和氧气,正氧负氢,体积比是1:2,所以图甲试管1得到的气体是氢气,水电解的化学方程式为: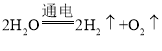 ;
;
Ⅱ.化学反应前后元素种类不变,所以电解水实验证明了水由氢元素和氧元素组成;电解水过程中保持不变的微粒是氢原子和氧原子,;
III、20℃时,将等质量的甲、乙固体,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,烧杯甲中有固体剩余,所以20℃时,甲物质的溶解度小于乙物质的溶解度,加热到50℃时现象如图2,甲物质的溶解度大于乙物质的溶解度,所以
A、图3中M表示的是甲的溶解度曲线,故错误;
B、图2中,溶质质量相等,溶剂质量相等,所以甲、乙溶液的溶质质量分数相等,故正确;
C、温度为30℃是,甲乙物质溶解度相等,且此时乙溶液必为不饱和溶液,所以甲也一定全部溶解,温度升高到50℃时,甲溶液必为不饱和溶液,故正确;
D、图1中,甲物质有剩余,所以甲溶液溶质质量分数小于乙溶液溶质质量分数,故错误。
故选:BC。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案