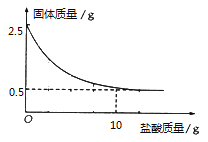
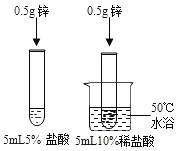
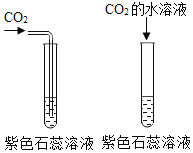
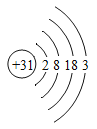
题目内容
【题目】实验室中的试剂一般要密封保存,否则可能会与空气接触而变质。某研究性学习小组发现一瓶未密闭的KOH固体,对其成分提出以下假设,并完成了实验探究。
假设1:只含KOH; 假设2:含KOH和K2CO3; 假设3:只含K2CO3
①成分中可能含有K2CO3的原因是(用化学方程式回答)______。
②取少量样品于试管中,加入足量稀盐酸,观察到______,说明假设2或假设3成立。
③进一步探究的过程如下:
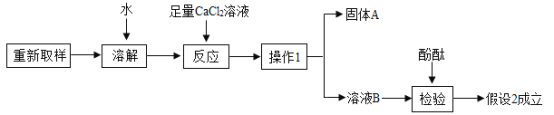
a“操作1”的名称是______;
b“固体A”的化学式是______;
c加入足量CaCl2溶液的作用是______;
【答案】2KOH+CO2=K2CO3+H2O 有气体产生 过滤 CaCO3 将碳酸钾完全反应,防止对氢氧化钾检验的干扰
【解析】
①氢氧化钾易吸收空气中的二氧化碳气体,产生碳酸钾和水,反应的方程式为:2KOH+CO2=K2CO3+H2O;故填:2KOH+CO2=K2CO3+H2O
②在检验是否变质时,只需检验碳酸钾存在,所以加入盐酸检验是否有气体产生,若产生气泡则说明含有碳酸钾,说明假设2或假设3成立;故填:有气体产生
③a“操作1”是将物质分成固体和液体,因此是过滤;故填:过滤
b “固体A”是变质后的碳酸钾和氯化钙反应产生的碳酸钙沉淀,化学式是为:CaCO3;故填:CaCO3
c在证明氢氧化钾部分变质时,因碳酸钾溶液也显碱性,因此加入足量的氯化钙先除去碳酸钾后再证明剩余溶液显碱性,故加入足量CaCl2溶液的作用是:将碳酸钾完全反应,防止对氢氧化钾检验的干扰;故填:将碳酸钾完全反应,防止对氢氧化钾检验的干扰

练习册系列答案
相关题目