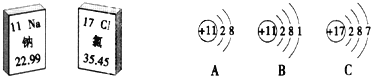题目内容
【题目】金属材料广泛应用于工业、农业、交通和日常生活等领域。
(1)黄铜、生铁都是生活中常见的两种_____(选填“合金”或“纯金属”)。
(2)体温计中的金属是_____。
(3)铝耐腐蚀是因为表面形成_____(填化学式)。
(4)工业用赤铁矿石炼铁的化学方程式为_____。
(5)钛合金是人造骨的重要材料。要比较钛(Ti)和铁的金属活动性强弱,以下方法不能达到目的是_____。
A 查阅初中化学课本上的金属活动性顺序表 B 利用金属钛和FeCl2溶液进行实验
C 利用金属铁和TiSO4溶液进行实验 D 利用金属钛、铁与稀硫酸进行实验
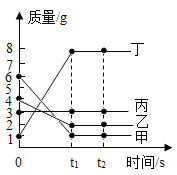
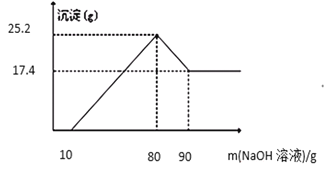
(6)含有锌6.5g、铁5.6g、铜6.4g、铝2.7g的混合粉末与一定质量的稀硫酸充分反应后,有9.2g固体剩余,则生成氢气质量为_____g,所得溶液中溶质的质量是_____g。
【答案】合金 汞 Al2O3 Fe2O3+3CO![]() 2Fe+3CO2 A 0.6 24.7
2Fe+3CO2 A 0.6 24.7
【解析】
(1)黄铜、生铁都是生活中常见的两种合金。故填:合金
(2)体温计中的金属是汞。故填:汞
(3)铝耐腐蚀是因为表面形成致密的氧化铝的薄膜,化学式是:Al2O3。故填:Al2O3
(4)工业用赤铁矿石炼铁的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2。故填:Fe2O3+3CO
2Fe+3CO2。故填:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
(5)A.初中化学课本上的金属活动性顺序表中没有钛,不能比较钛与铁的活动性顺序;
B.利用金属钛和FeCl2溶液进行实验,能比较钛与铁的活动性顺序;
C.利用金属铁和TiSO4溶液进行实验,能比较钛与铁的活动性顺序;
D.利用金属钛、铁与稀硫酸进行实验,根据金属与酸反应的难易程度可以比较金属的活动性强弱。
故填:A
(6)设锌与硫酸反应生成氢气质量为x,生成硫酸锌的质量为m
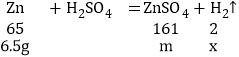
![]() ,解得:x=0.2g m=16.1g
,解得:x=0.2g m=16.1g
设铁与硫酸反应生成氢气质量为y,生成的硫酸亚铁的质量为n
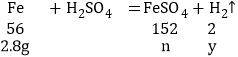
![]() ,解得:y=0.1g n=7.6g
,解得:y=0.1g n=7.6g
设铝与硫酸反应生成氢气质量为z,生成硫酸铝的质量为p
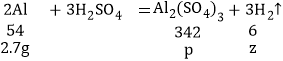
![]() ,解得:z=0.3g p=17.1g
,解得:z=0.3g p=17.1g
则生成氢气的总质量为:0.2g+0.1g+0.3g=0.6g。
所得溶液中溶质的质量是:16.1g+7.6g+17.1g=24.7g。故填:0.6;24.7

 应用题作业本系列答案
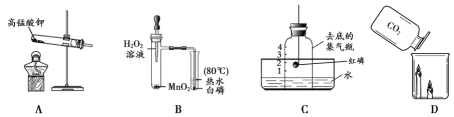
应用题作业本系列答案【题目】化学实验小组同学在实验室用过氧化氢溶液制氧气。
(1)用过氧化氢和二氧化锰反应的化学方程式为:__________________________。
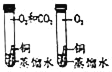
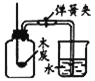
(2)同学们发现反应时有白雾产生,用如下两个装置来找原因,其目的是:___________。
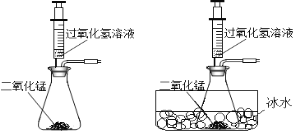
同时又展开了下列思考与探究:
(3)催化剂MnO2的用量对反应速率是否有影响呢?
他们做了这样一组实验:每次均用30mL10%的H2O2溶液,采用不同质量MnO2粉末做催化剂,测定各次收集到500mL氧气所用的时间,结果如下:(其它实验条件均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
MnO2粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
所用时间(秒) | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 | 2 |
请根据表中数据回答,MnO2粉末的用量对反应速率的影响是___________。
(4)H2O2溶液的溶质质量分数对反应速率是否有影响呢?小组同学又做了一组实验:
每次均取5mL30%的H2O2溶液,然后稀释成不同溶质质量分数的溶液进行实验。记录数据如下:(实验均在20℃室温下进行,其它实验条件均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
H2O2溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2粉末用量(克) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
收集到540mL气体时所用时间(秒) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
分析表中数据可得出的结论是___________。
(3)实验反思:MnO2颗粒的大小对反应速率是否有影响?请设计实验证明(语言叙述,不用画装置图)___________。