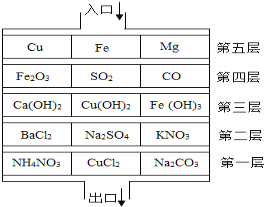
��Ŀ����
����Ŀ����ѧʵ��С��ͬѧ��ʵ�����ù���������Һ��������
��1���ù�������Ͷ������̷�Ӧ�Ļ�ѧ����ʽΪ��__________________________��
��2��ͬѧ�Ƿ��ַ�Ӧʱ�а�������������������װ������ԭ����Ŀ���ǣ�___________��
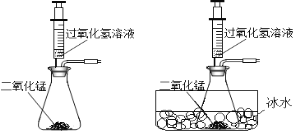
ͬʱ��չ��������˼����̽����
��3������MnO2�������Է�Ӧ�����Ƿ���Ӱ���أ�
������������һ��ʵ�飺ÿ�ξ���30mL10%��H2O2��Һ�����ò�ͬ����MnO2��ĩ���������ⶨ�����ռ���500mL�������õ�ʱ�䣬������£�������ʵ����������ͬ��
ʵ����� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
MnO2��ĩ�������ˣ� | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
����ʱ�䣨�룩 | 17 | 8 | 6 | 3 | 2 | 2 | 2 | 2 | 2 | 2 |
����ݱ������ݻش�MnO2��ĩ�������Է�Ӧ���ʵ�Ӱ����___________��
��4��H2O2��Һ���������������Է�Ӧ�����Ƿ���Ӱ���أ�С��ͬѧ������һ��ʵ�飺
ÿ�ξ�ȡ5mL30%��H2O2��Һ��Ȼ��ϡ�ͳɲ�ͬ����������������Һ����ʵ�顣��¼�������£���ʵ�����20�������½��У�����ʵ����������ͬ��
ʵ����� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
H2O2��Һ������������ | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2��ĩ�������ˣ� | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
�ռ���540mL����ʱ����ʱ�䣨�룩 | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
�����������ݿɵó��Ľ�����___________��
��3��ʵ�鷴˼��MnO2�����Ĵ�С�Է�Ӧ�����Ƿ���Ӱ�죿�����ʵ��֤�����������������û�װ��ͼ��___________��
���𰸡�![]() �����IJ����Ƿ����¶��йأ��¶ȵ��Ƿ��а����� ��һ����Χ�ڣ�MnO2������Խ��Ӧ����Խ�죻���ǵ�MnO2�ﵽ0.5g������ʱ�����ͬ�ˡ�������һ����Χ������MnO2�ӿ췴Ӧ�ٶȡ� ����������ͬʱ��H2O2��Һ��������������Խ��ӦԽ�졣 ��������ĩ״�Ϳ�״��MnO2����������ͬ�������У�ͬʱ����ͬ���ͬŨ�ȵĹ���������Һ���ⶨ�ռ���ͬ������������õ�ʱ�䡣������ͬ��ʱ���¼�ռ���������������
�����IJ����Ƿ����¶��йأ��¶ȵ��Ƿ��а����� ��һ����Χ�ڣ�MnO2������Խ��Ӧ����Խ�죻���ǵ�MnO2�ﵽ0.5g������ʱ�����ͬ�ˡ�������һ����Χ������MnO2�ӿ췴Ӧ�ٶȡ� ����������ͬʱ��H2O2��Һ��������������Խ��ӦԽ�졣 ��������ĩ״�Ϳ�״��MnO2����������ͬ�������У�ͬʱ����ͬ���ͬŨ�ȵĹ���������Һ���ⶨ�ռ���ͬ������������õ�ʱ�䡣������ͬ��ʱ���¼�ռ���������������
��������
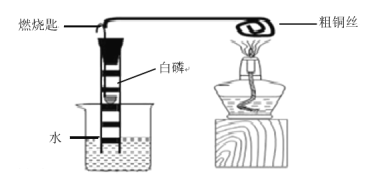
��1�����������ڶ������̵Ĵ������·ֽ�Ϊˮ�����������![]()
��2����������ֽ���������Ĺ����п��ܻ�ų�������ʹ��ˮ�������γɰ�����������ͼʾ����װ������ԭ����Ŀ���ǣ������IJ����Ƿ����¶��йػ��¶ȵ��Ƿ��а�������������IJ����Ƿ����¶��йأ����¶ȵ��Ƿ��а�������
��3���ɱ����е����ݿ�֪����һ����Χ�ڣ�MnO2������Խ��Ӧ����Խ�죻���ǵ�MnO2�ﵽ0.5g������ʱ�����ͬ�ˡ�������һ����Χ������MnO2�ӿ췴Ӧ�ٶȣ������һ����Χ�ڣ�MnO2������Խ��Ӧ����Խ�죻���ǵ�MnO2�ﵽ0.5g������ʱ�����ͬ�ˡ�������һ����Χ������MnO2�ӿ췴Ӧ�ٶȣ�
��4���ɱ����е����ݿ�֪������������ͬʱ��H2O2��Һ��������������Խ��ӦԽ�죻�������������ͬʱ��H2O2��Һ��������������Խ��ӦԽ�죻
��5��̽��MnO2�����Ĵ�С�Է�Ӧ�����Ƿ���Ӱ��ʱ���������̵���������ȣ�����������Һ�������Ũ��Ҫ��ȫ��ͬ��ͨ���ⶨ�ռ���ͬ�������������ʱ�䣨����ͬ��ʱ���¼�ռ����������������Ƚϣ������������ĩ״�Ϳ�״��MnO2����������ͬ�������У�ͬʱ����ͬ���ͬŨ�ȵĹ���������Һ���ⶨ�ռ���ͬ������������õ�ʱ�����ͬ��ʱ���¼�ռ���������������

 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�����Ŀ��Ϊ���о����ʵ��ܽ�����������̽�����
̽��I����������̼���ơ��Ȼ��ƺ�������������ʷֱ��ܽ���һ������ˮ�У��ܽ���̵��¶ȱ仯����ͼ��ʾ��
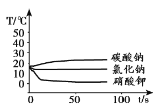
̽��II��
ʵ�� |
�� |
�� |
�� |
���� | �����ܽ⣬ �γ��Ϻ�ɫ��Һ | �����ܽ⣬�γ��Ϻ�ɫ��Һ | ���弸�����ܽ� |
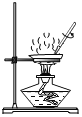
̽��III�� ̽����������ͼ��ʾ��
�ش��������⣺
��1��̽��I�У��ܽ���̷ų�������������__________��
��2����̽��II��ʵ��������з�������Ҫ���ĶԱ���________�������ó��Ľ���֮һ��__________��
��3��̽��III�У�������Һһ�����ڱ�����Һ����__________��ͨ����̽���ó��Ľ�����__________����һ�㼴�ɣ���
��4��������̽���Ļ����ϣ�ͬѧ����ͨ��̽�����Ƚ�ʳ�κ��Ȼ����ˮ�е��ܽ�ȴ�С��̽������Ӧ����__________��
����Ŀ��ijУ��ѧ��ȤС��ι��Ƽ���������Ϣ���������������о���
��Ʒԭ�����ó����á������Ƽ������������Ʒ�������Na2CO3���ͻ���NH4Cl��
����ԭ���ǣ���NH3��CO2ͨ�뱥��ʳ��ˮ�еõ�NaHCO3�����NH4Cl��Һ����Ӧ�Ļ�ѧ����ʽΪ��_____��������NaHCO3�������Ƶô��
�������̣�
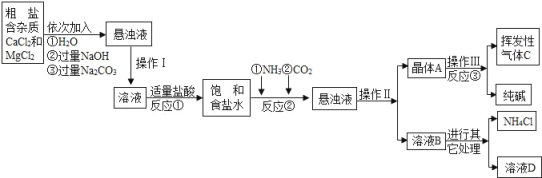
������ϣ�
��1��NH4Cl ![]() NH3��+HCl��
NH3��+HCl��
��2����֪20��ʱ�й����ʵ��ܽ�����£�����ָ1���ˮ�����ܽ�����������
���� | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
�ܽ�� | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
�������ۣ�
��1���������У���ͬ����������Ϊ_____����Ӧ���з�����������Ӧ��д������һ����ѧ����ʽ��_____����Ӧ�������������ᣬ������ָ_____��
��2������ӷ�������C�ķ���_____��
��3���������������п�ѭ��ʹ�õ���_____������ţ���
A�ӷ�������C�� B��ҺD�� C������þ��D����NH4Cl
���ȷ����
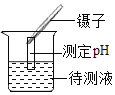
��1����ȡһ�������Ĵ�����Ʒ������γ�ּ��Ⱥ��ٳ��أ������ޱ仯��
��2����ȡ����������Ʒ��������ˮ����Ʒ��ȫ�ܽ⣬�����Һ�м������ϡHNO3���ٵμ�AgNO3��Һ���а�ɫ������������ʵ���ȷ��������Ʒ��������_____��д��ѧʽ����
�����ⶨ��
ʵ��һ | ʵ��� | ʵ���� | ʵ���� | |
����������Һ���� | 100g | 100g | 100g | 100g |
����CaCl2��Һ���� | 10g | 20g | 30g | 40g |
���ɵij��������� | 4g | m | 10g | 10g |
��ȡ�ô�����Ʒ44g���������ˮ���400g��Һ��ƽ����Ϊ�ķݣ�Ȼ��ֱ����һ������������CaCl2��Һ��ʵ�����ݼ�����
������������ݻش��㣺
��1��m��_____g��
��2����ʵ�����У���ȫ��Ӧ��������Һ�������Ȼ��Ƶ����������Ƕ��٣�_____��Ҫ��д������̣��������0.1%��
�ܽᷴ˼��
��ͨ�����㲢����±��жϴ˴�����Ʒ�ȼ�Ϊ_____Ʒ��������������ⶨ�У���CaCl2��Һ��ΪBaCl2��Һ���ⶨ�����С��
��ҵ���������Na2CO3% �� | |||
�ŵ�Ʒ | һ��Ʒ | �ϸ�Ʒ | ��Ʒ |
��95 | ��80 | ��75 | ��40 |
����Ŀ���ճ�������ʹ�õ����ϴ����þ���ϩ�Ƴɵģ�Ҳ���þ�����ϩ�Ƴɵġ�С��ͬѧ��˵��װʳƷ�����ϴ�Ӧ����ǰ�߶����Ǻ��ߣ��������һ��ʵ�鷽������ƽ���ڳ�������ʱ�����������ϴ�����̽��������֤��ɷ֡�
�������ϣ�����ϩȼ������CO2��H2O��������ϩȼ�ճ�������CO2��H2O֮�⣬������HCl���������
ʵ��̽����С��������ʵ��װ�ð�ABCD˳�����Ӻã�Ȼ�����̽����
(1)��ʵ���������B��C��Dװ�ö��������Ե�����������ϴ�����______�Ƴɵġ�(����������ϩ����������ϩ��)
ʵ�鷴˼������ʵ��װ��ʱ���ܷ�װ��C��D˳��������������
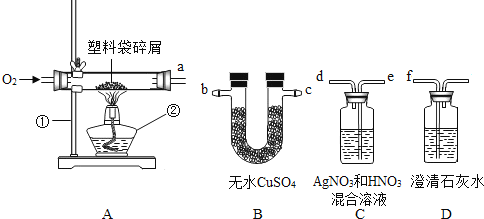
��______������______
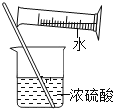
����̽����С��Ϊ�˲ⶨ����ϩ����ɣ�ȡ��5.6g����ϩ������Ƭ����Ӳ�ʲ������У�������������ʹ֮ȼ�գ�������������ͨ��������Ũ���������������Һ�У�����ʵ������¼���±��С�ʵ������
ʵ��ǰ | ʵ��� | |
Bװ�õ�����/g | 213.6 | 220.8 |
Cװ�õ�����/g | 200.2 | 217.8 |
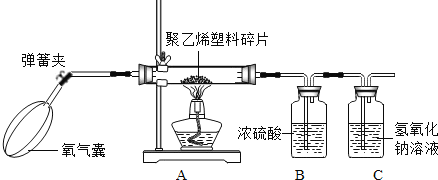
(2)����ʵ���������жϣ�����ϩȼ�����ɵ�ˮ��������______��������̼��������______��
(3)����ϩ���Ƿ�����Ԫ��______(����������������)��̼��Ԫ�ص�������Ϊ______��