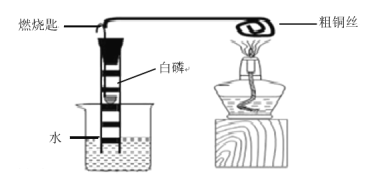
题目内容
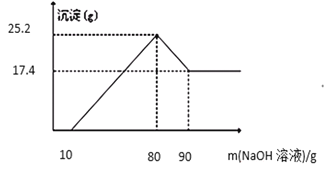
【题目】将一定质量的Mg、Al合金投入100g一定浓度的盐酸中,合金全部溶解,向所得溶液中滴加NaOH溶液至过量,生成沉淀的质量与加入NaOH的质量关系如图所示。(已知:Al(OH)3沉淀能与NaOH溶液反应,反应方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,Mg(OH)2沉淀不能与NaOH溶液反应。)求:
(1)Al(OH)3的质量为_____________克
(2)原合金中Mg和Al的质量比为______(化为最简单整数比);
(3)所用盐酸的质量分数为_____?
【答案】7.8 8︰3 29.2﹪
【解析】
(1)根据生成沉淀的质量与加入NaOH的质量关系图可知,加入10g氢氧化钠溶液开始产生沉淀,加入到80g时,沉淀量达到最大值25.2g,再加入氢氧化钠,根据题意可知,Al(OH)3沉淀能与NaOH溶液反应,Mg(OH)2沉淀不能与NaOH溶液反应,沉淀溶解,最后得到17.4g沉淀是氢氧化镁,Al(OH)3的质量=25.2g-17.4g=7.8g;
(2)根据质量守恒定律可知,氢氧化镁中镁元素质量等于金属镁的质量,氢氧化铝中铝元素质量等于金属铝的质量。氢氧化镁中镁元素质量=![]() ;氢氧化铝中铝元素质量=
;氢氧化铝中铝元素质量=![]() ;原合金中Mg和Al的质量比=7.2g:2.7g=8:3;
;原合金中Mg和Al的质量比=7.2g:2.7g=8:3;
(3)设:与7.8g氢氧化铝反应的氢氧化钠质量为x。
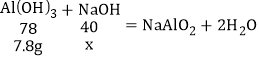
![]() x=4g;氢氧化钠的溶质质量分数=
x=4g;氢氧化钠的溶质质量分数=![]() ;
;
80g的氢氧化钠溶液中氢氧化钠的质量=80g×40%=32g;当加入氢氧化钠溶液质量为80g时,根据化学方程式:![]() ,
,![]()
![]() ,
,![]() ,
,![]() 可知,氢氧化钠中的钠元素全部转化到氯化钠中,氯化钠中的氯离子全部来自盐酸。设盐酸中氯化氢的质量为y。
可知,氢氧化钠中的钠元素全部转化到氯化钠中,氯化钠中的氯离子全部来自盐酸。设盐酸中氯化氢的质量为y。
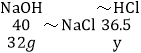
![]() y=29.2g;所用盐酸的质量分数=
y=29.2g;所用盐酸的质量分数=![]() 。
。

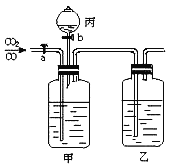
【题目】日常生活中使用的塑料袋有用聚乙烯制成的,也有用聚氯乙烯制成的。小明同学听说包装食品的塑料袋应该是前者而不是后者,便设计了一个实验方案,用平常在超市买东西时带回来的塑料袋进行探究,以验证其成分。
查阅资料:聚乙烯燃烧生成CO2和H2O;聚氯乙烯燃烧除了生成CO2和H2O之外,还会有HCl气体产生。
实验探究:小明将以下实验装置按ABCD顺序连接好,然后进行探究。
(1)在实验过程中若B、C、D装置都产生明显的现象,则该塑料袋是用______制成的。(填“聚氯乙烯”或“聚乙烯”)
实验反思:连接实验装置时,能否将装置C、D顺序调换?请简述。
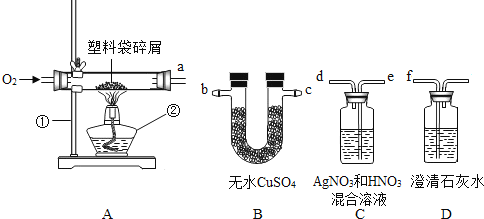
答:______理由是______
继续探究:小明为了测定聚乙烯的组成,取了5.6g聚乙烯塑料碎片放在硬质玻璃管中,鼓入充足的氧气使之燃烧,将产生的气体通入足量的浓硫酸和氢氧化钠溶液中,并将实验结果记录在下表中。实验结果:
实验前 | 实验后 | |
B装置的质量/g | 213.6 | 220.8 |
C装置的质量/g | 200.2 | 217.8 |
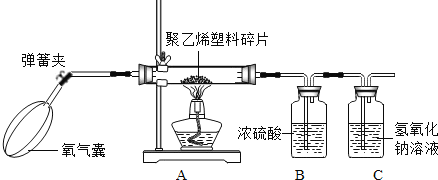
(2)根据实验结果可以判断:聚乙烯燃烧生成的水的质量是______;二氧化碳的质量是______。
(3)聚乙烯中是否含有氧元素______(填“有”或“无”);碳氢元素的质量比为______。