题目内容
【题目】氨用于制造氮肥(尿素、碳铵等)、复合肥料、硝酸、纯碱等,广泛应用于化工、轻工、化肥制药、合成纤维等领域。
Ⅰ.工业制氨是以哈伯法通过氮气和氢气在高温高压和催化剂的作用下化合生成的,请算出氮气与氢气恰好完全反应时的质量比________;
Ⅱ.目前有一种“人工固氮”的新方法反应过程示意图如下:
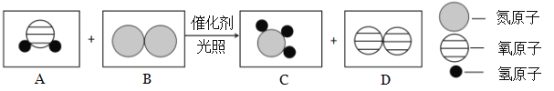
(1)根据反应的微观示意图写出化学方程式:_____________;
(2)氨气进入大气后与雨水作用,可能形成“碱雨”。写出碱雨中碱的化学式,并标出其中氮元素的化合价:_________;
Ⅲ.氨是氮肥的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
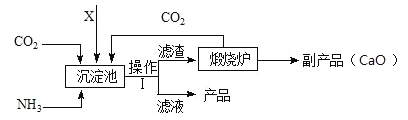
(1)操作Ⅰ中的玻璃棒作用是_________;
(2)加入的X应为_____(填字母)
A H2SO4 B CaSO4 C SO2
Ⅳ.氨也是工业索维尔法制纯碱的重要原料。
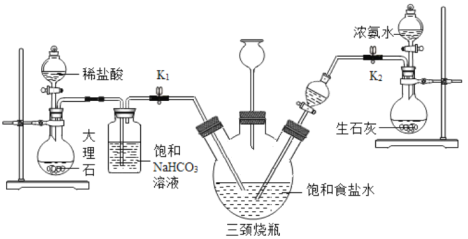
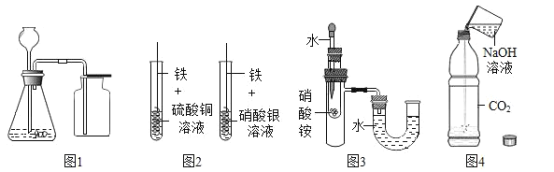
某兴趣小组采用下列装置模拟索维尔法制备碳酸氢钠,实验操作如下:
a.关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
b.待三颈烧瓶内出现较多NaHCO3固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
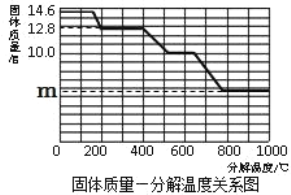
c.将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 30.6 | 27.4 | 23.8 | 21.2 | 21.2 |
(资料)常温常压下,1体积水约能溶解700体积氨气,1体积水约能溶解1体积二氧化碳。
请回答下列问题:
(1)三颈烧瓶内生成的另一产物是一种铵态氮肥,写出其中发生的化学反应方程式:__________;加热过滤得到的NaHCO3,发生反应:2NaHCO3 ![]() Na2CO3 + CO2↑+ H2O。
Na2CO3 + CO2↑+ H2O。
(2)三颈烧瓶上连接的长颈漏斗的主要作用是__________;
(3)打开K2通入NH3一段时间后,才打开K1通入CO2,原因是__________;
(4)饱和碳酸氢钠溶液的作用是______________;
(5)根据实验记录,计算t2 min时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程__________。
【答案】28:6(或14:3) 6H2O + 2N2  4NH3 + 3O2 NH3H2O 引流 B NaCl + H2O + CO2 + NH3 ═ NaHCO3↓ + NH4Cl 控制瓶内气压与外界大气压一致 NH3在水中溶解度比CO2大,先通入氨气后溶液呈碱性,利于吸收更多CO2 吸收CO2中的HCl气体,防止影响实验 50%。
4NH3 + 3O2 NH3H2O 引流 B NaCl + H2O + CO2 + NH3 ═ NaHCO3↓ + NH4Cl 控制瓶内气压与外界大气压一致 NH3在水中溶解度比CO2大,先通入氨气后溶液呈碱性,利于吸收更多CO2 吸收CO2中的HCl气体,防止影响实验 50%。
【解析】
Ⅰ.工业上氨是以哈伯法通过N2和H2在高温高压和催化剂存在下直接化合而制成,其中N2和H2恰好完全反应时的分子个数比为1:3,则质量比为![]() ;
;
Ⅱ.(1)由微观示意图可知,反应物是水和氮气,生成物是氨气和氧气,故反应方程式为6H2O + 2N2  4NH3 + 3O2;
4NH3 + 3O2;
(2)氨气与水反应生成氨水,生成的氨水化学式为NH3H2O;氨水中氢元素的化合价为+1价,根据化合价的代数和为0可求得氮元素的化合价为-3价;
Ⅲ.(1)操作Ⅰ为过滤,其中的玻璃棒作用是引流;
(2)加入的X应该是硫酸钙,因为加入硫酸钙后才能有滤渣碳酸钙沉淀生成,碳酸钙分解才能生成二氧化碳通入沉淀池中,选项B正确。
Ⅳ.(1)向三颈烧瓶内的食盐水中先通入NH3再通入CO2,生成铵态氮肥和碳酸氢钠,根据元素守恒还应生成水,则反应方程式NaCl + H2O + CO2 + NH3 ═ NaHCO3↓ + NH4Cl;
(2)三颈烧瓶上连接的长颈漏斗的主要作用是控制瓶内气压与外界大气压一致;
(3)NH3在水中溶解度比CO2大,先通入氨气后溶液呈碱性,利于吸收更多CO2,所以先打开K2通入NH3一段时间后,才打开K1通入CO2;
(4)饱和碳酸氢钠溶液的作用是为了吸收CO2中的HCl气体,防止影响实验;
(5)设原混合物中碳酸氢钠的质量为X
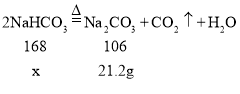
![]()
x=33.6g
完全反应时剩余固体减少33.6g-21.2g=12.4g,
t2时固体的质量减少了33.6g-27.4g=6.8g,
t2时固体减少的质量为完全反应时的一半,则t2 min时NaHCO3固体的分解率为50%。

【题目】溶液与人们的生活息息相关。
(1)以下是有关CO2气体溶解度的几组数据:
CO2在水中的溶解度(单位:mL)
压强/大气压 | 温度/℃ | ||||
0 | 25 | 50 | 75 | 100 | |
1 | 1.79 | 0.752 | 0.423 | 0.307 | 0.231 |
10 | 15.92 | 7.14 | 4.095 | 2.99 | 2.28 |
25 | 29.30 | 16.20 | 9.71 | 6.82 | 5.73 |
请根据数据
①根据CO2在水中的溶解度表,叙述外界条件是如何影响气体溶解度的?_____。
②打开可乐瓶有气体溢出,说明原瓶中的压强_____(填“大于”“小于”或“等于”)瓶外大气压强。
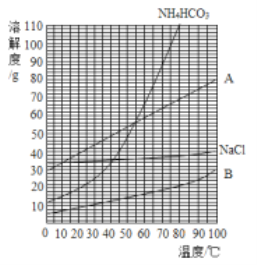
(2)以饱和NaCl溶液跟饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3=NaHCO3↓+NH4Cl,该反应中的四种物质的溶解度曲线如图所示。
请回答下列问题。
①35℃时,比较A、B溶解度的大小:A_____B。
②图中表示碳酸氢钠溶解度曲线的是_____(填“A”或“B”)。
③发生上述反应析出晶体后的母液是碳酸氢钠的_____(填“饱和”或“不饱和”)溶液。写出母液中所有溶质的化学式_____。