题目内容
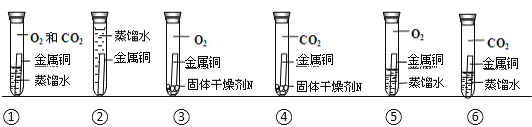
【题目】利用下列实验装置进行实验,能达到目的的是
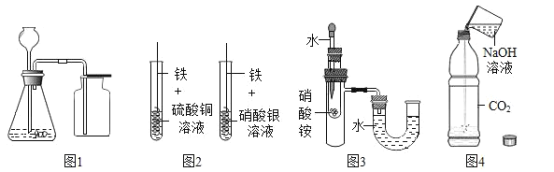
A. 图1装置可用锌粒和稀硫酸制取H2或用大理石和稀盐酸制取CO2
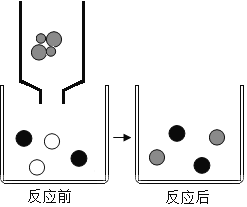
B. 图2装置铁丝表面均有固体析出可探究金属活动性:Fe>Cu>Ag
C. 图3装置看到U型管水面左高右低可验证NH4NO3溶于水吸热
D. 图4装置根据软塑料瓶变瘪可证明CO2能与NaOH反应
【答案】C
【解析】
A、用锌粒和稀硫酸制取氢气,是固体与液体反应,不要加热,发生装置正确,H2的密度比空气小,应选择向下排空气法,不可用图1装置;大理石和稀盐酸制取CO 2可用图1装置,选项A不正确;
B、图2装置铁丝表面均有固体析出,只能说明金属活动性:Fe>Cu和Fe>Ag,不能说明铜和银之间的金属活动性关系,选项B不正确;
C、图3中NH4NO3溶于水吸热,则左侧温度降低,左侧瓶内气压下降,右侧的U型管水面左高右低,选项C正确;
D、图4装置软塑料瓶变瘪可能是CO2能与NaOH反应造成,也可能是CO2溶于NaOH溶液中的水造成的,选项D不正确。故选C。

【题目】氨用于制造氮肥(尿素、碳铵等)、复合肥料、硝酸、纯碱等,广泛应用于化工、轻工、化肥制药、合成纤维等领域。
Ⅰ.工业制氨是以哈伯法通过氮气和氢气在高温高压和催化剂的作用下化合生成的,请算出氮气与氢气恰好完全反应时的质量比________;
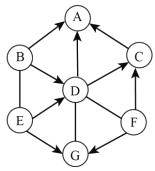
Ⅱ.目前有一种“人工固氮”的新方法反应过程示意图如下:
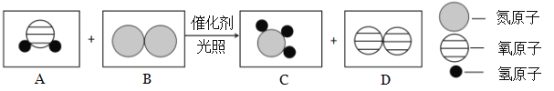
(1)根据反应的微观示意图写出化学方程式:_____________;
(2)氨气进入大气后与雨水作用,可能形成“碱雨”。写出碱雨中碱的化学式,并标出其中氮元素的化合价:_________;
Ⅲ.氨是氮肥的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
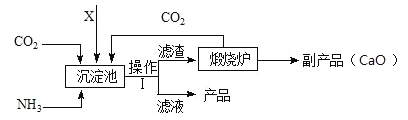
(1)操作Ⅰ中的玻璃棒作用是_________;
(2)加入的X应为_____(填字母)
A H2SO4 B CaSO4 C SO2
Ⅳ.氨也是工业索维尔法制纯碱的重要原料。
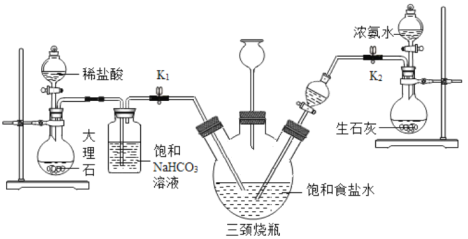
某兴趣小组采用下列装置模拟索维尔法制备碳酸氢钠,实验操作如下:
a.关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
b.待三颈烧瓶内出现较多NaHCO3固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
c.将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 30.6 | 27.4 | 23.8 | 21.2 | 21.2 |
(资料)常温常压下,1体积水约能溶解700体积氨气,1体积水约能溶解1体积二氧化碳。
请回答下列问题:
(1)三颈烧瓶内生成的另一产物是一种铵态氮肥,写出其中发生的化学反应方程式:__________;加热过滤得到的NaHCO3,发生反应:2NaHCO3 ![]() Na2CO3 + CO2↑+ H2O。
Na2CO3 + CO2↑+ H2O。
(2)三颈烧瓶上连接的长颈漏斗的主要作用是__________;
(3)打开K2通入NH3一段时间后,才打开K1通入CO2,原因是__________;
(4)饱和碳酸氢钠溶液的作用是______________;
(5)根据实验记录,计算t2 min时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程__________。