题目内容
【题目】下面是某学习小组在探究稀盐酸和氢氧化钠溶液是否发生反应的实验过程。
(1)图1是甲小组同学向滴有酚酞的稀盐酸中滴加NaOH溶液,振荡后溶液仍为无色,此现象_____(填“能”或“不能”)证明氢氧化钠与盐酸发生了反应。
(2)乙小组做了如图2所示的实验,回答下列问题。
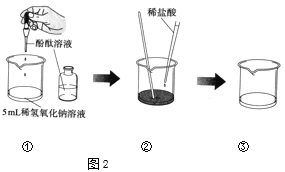
①实验中滴入酚酞溶液的目的是______。
②实验中反应的化学方程式是______。
③实验步骤①和②两次使用了滴管,用完后需要洗涤的是_____(在“①”、“②”、“①和②”之中三选一填写)。
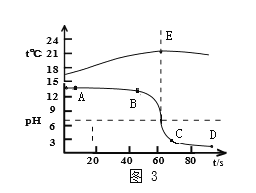
(3)丙小组用温度和pH传感器检测反应过程中温度和pH的变化,测得结果如图3所示。
①E点的意义____。
②BC段pH变化很快的原因_____。
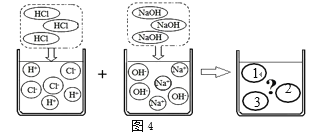
③如图4是氢氧化钠与盐酸发生中和反应的微观实质,如果1处填写Cl-,2、3分别应填写______、_____。
(4)丁组通过检测溶液导电性变化判断酸碱是否发生了反应。
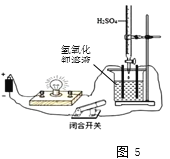
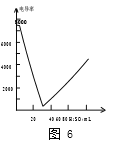
①如图5,闭合开关,小灯泡发光,说明氢氧化钡溶液能导电,导电的原因是____。滴加稀硫酸至过量,小灯泡由亮变暗,再由暗变亮,同时用传感器测得烧杯中溶液的导电率变化如图6,该反应的化学方程是______。
 ,
, 
②检测溶液导电性_____(填“能”或“不能”)证明氢氧化钠与盐酸发生了反应。
【答案】能 证明氢氧化钠溶液与稀盐酸恰好完全反应 NaOH+HCl=NaCl+H2O ② 60秒时氢氧化钠与盐酸恰好完全反应,放出热量最多,温度最高 溶液中的碱较少,随着酸液的滴加,碱很快与酸完全反应,而且酸很快过量 Na+ H2O 溶液中有自由移动的带电离子:OH-、Ba2+ Ba(OH)2+H2SO4=BaSO4↓ +2H2O 不能
【解析】
(1)当滴入氢氧化钠后酚酞不变为红色,说明氢氧化钠没有与酚酞反应,而与稀盐酸反应,故证明氢氧化钠与盐酸发生了反应。
(2)①该实验中先滴入酚酞,氢氧化钠变为红色,当加入稀盐酸并不断的搅拌,当稀盐酸与氢氧化钠恰好完全反应时,红色消失,故实验中滴入酚酞溶液的目的是证明氢氧化钠溶液与稀盐酸恰好完全反应;②该实验中氢氧化钠与稀盐酸反应生成氯化钠和水,反应的方程式为:NaOH+HCl=NaCl+H2O;③滴瓶上的胶头滴管不需要清洗,防止将原药品污染,而其他的滴管要清洗,防止互相使用污染试剂,故选②。
(3)①由图可知,E点表示60秒时氢氧化钠与盐酸恰好完全反应,放出热量最多,温度最高。
②BC段pH变化很快的原因溶液中的碱较少,随着酸液的滴加,碱很快与酸完全反应,而且酸很快过量。
③中和反应的实质是酸中的氢离子和碱中的氢氧根离子反应生成水分子,故当1处填写Cl-,则2、3分别应填写Na+和H2O
(4)①氢氧化钡溶液中含有可自由移动的钡离子和氢氧根离子,故溶液导电;氢氧化钡与稀硫酸反应生成硫酸钡沉淀水水,反应的方程式为:Ba(OH)2+H2SO4=BaSO4↓ +2H2O。②氢氧化钠与稀盐酸反应后生成水和氯化钠,溶液中仍然含有可自由移动的离子,故可以继续导电,故不能证明。

【题目】氨用于制造氮肥(尿素、碳铵等)、复合肥料、硝酸、纯碱等,广泛应用于化工、轻工、化肥制药、合成纤维等领域。
Ⅰ.工业制氨是以哈伯法通过氮气和氢气在高温高压和催化剂的作用下化合生成的,请算出氮气与氢气恰好完全反应时的质量比________;
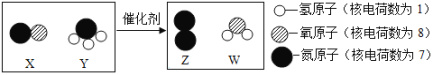
Ⅱ.目前有一种“人工固氮”的新方法反应过程示意图如下:
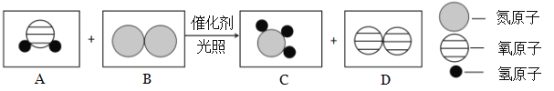
(1)根据反应的微观示意图写出化学方程式:_____________;
(2)氨气进入大气后与雨水作用,可能形成“碱雨”。写出碱雨中碱的化学式,并标出其中氮元素的化合价:_________;
Ⅲ.氨是氮肥的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
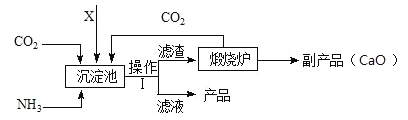
(1)操作Ⅰ中的玻璃棒作用是_________;
(2)加入的X应为_____(填字母)
A H2SO4 B CaSO4 C SO2
Ⅳ.氨也是工业索维尔法制纯碱的重要原料。
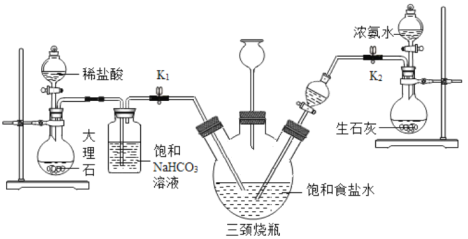
某兴趣小组采用下列装置模拟索维尔法制备碳酸氢钠,实验操作如下:
a.关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
b.待三颈烧瓶内出现较多NaHCO3固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
c.将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 30.6 | 27.4 | 23.8 | 21.2 | 21.2 |
(资料)常温常压下,1体积水约能溶解700体积氨气,1体积水约能溶解1体积二氧化碳。
请回答下列问题:
(1)三颈烧瓶内生成的另一产物是一种铵态氮肥,写出其中发生的化学反应方程式:__________;加热过滤得到的NaHCO3,发生反应:2NaHCO3 ![]() Na2CO3 + CO2↑+ H2O。
Na2CO3 + CO2↑+ H2O。
(2)三颈烧瓶上连接的长颈漏斗的主要作用是__________;
(3)打开K2通入NH3一段时间后,才打开K1通入CO2,原因是__________;
(4)饱和碳酸氢钠溶液的作用是______________;
(5)根据实验记录,计算t2 min时NaHCO3固体的分解率(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程__________。