题目内容
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入30g稀硫酸,充分反应后测得实验结果如下:
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中铜的质量分数。
| 实验次数 | 1 | 2 | 3 |
| 稀硫酸质量 | 10g | 10g | 10g |
| 氢气质量 | 0.04g | m | 0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中铜的质量分数。
(1)0.04g (2)83.75%
(1)第一次加10克稀硫酸生成0.04克氢气,第三次加5克的稀硫酸还生成了0.02克的氢气,说明第二次反应中金属是过量的,也生成0.04克氢气,故答案为:0.04g;
(2)根据生成氢气的量和锌与稀硫酸反应的方程式中的等量关系进行分析。
解:设共生成(0.04g+0.04g+0.02g=0.1g)氢气,需金属锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑………………………………………………………………(1分)
65 2
X 0.1g
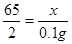 …………………………………………………………………(1分)
…………………………………………………………………(1分)
解得X="3.25g" ………………………………………………………………(1分)
合金中铜的质量分数: (20g—3.25g)/20g X100%=83.75%…………………(1分)
答:合金中铜的质量分数为83.75%。
(2)根据生成氢气的量和锌与稀硫酸反应的方程式中的等量关系进行分析。
解:设共生成(0.04g+0.04g+0.02g=0.1g)氢气,需金属锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑………………………………………………………………(1分)
65 2
X 0.1g
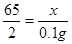 …………………………………………………………………(1分)
…………………………………………………………………(1分)解得X="3.25g" ………………………………………………………………(1分)
合金中铜的质量分数: (20g—3.25g)/20g X100%=83.75%…………………(1分)
答:合金中铜的质量分数为83.75%。

练习册系列答案
相关题目


 CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题:
CaCO3↓+CO2↑+H2O,得到沉淀1.0g.回答下列问题: