题目内容
(10分)石灰石是一种重要的矿产,小江同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验。
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 | 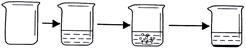 | |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
(1)该实验中生成的二氧化碳的质量是多少克?
(2)该石灰石样品的纯度是否符合要求?(假设石灰石样品中的杂质不与盐酸反应也不溶于水)
(1) 4.4g (2)不符合要求
(1)根据质量守恒定律可以知道生成二氧化碳的质量为:100.0g+12.0g-107.6g=4.4g
(2)解:设样品中碳酸钙的质量为X
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
100 44
X 4.4g
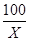 =
=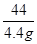 解得 X="10g"
解得 X="10g"
该石灰石样品的纯度为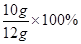 =83.3%
=83.3%
因为83.3% < 85%,所以该石灰石的纯度不符合要求
答:该石灰石的纯度不符合要求。
(2)解:设样品中碳酸钙的质量为X
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑
100 44
X 4.4g
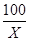 =
=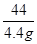 解得 X="10g"
解得 X="10g" 该石灰石样品的纯度为
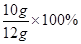 =83.3%
=83.3%因为83.3% < 85%,所以该石灰石的纯度不符合要求
答:该石灰石的纯度不符合要求。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目