题目内容
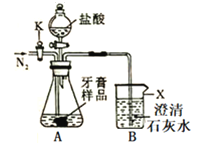
【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)初步探究:Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含________________;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有______ |
取上层清液,滴加_____ | ________ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是________(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)深入探究:在老师的指导下同学们取原固体,进行如下实验:
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_______;其中,操作X的名称是______,无色滤液中一定含有的阳离子是____________。
【答案】 CuSO4 Na2CO3 酚酞试液(或含有铜离子、铁离子、铵根离子的盐溶液) 溶液不变红(或不产生蓝色沉淀或红褐色沉淀或刺激性气味气体) 除尽碳酸钠溶液 B CaCO3 BaSO4 过滤 Na+
【解析】(一)定性探究:Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,结合硫酸铜溶液为蓝色,故原固体中一定不含CuSO4;
Ⅱ.由于氯化钙溶液与Na2CO3反应生成白色沉淀,所以原固体中一定含有碳酸钠;过量的氯化钙将碳酸钠除去,验证氢氧化钠的存在,取上层清液,滴加酚酞试液(或含有铜离子、铁离子、铵根离子的盐溶液),出现溶液不变红(或不产生蓝色沉淀或红褐色沉淀或刺激性气味气体)等现象,说明原固体中不含NaOH;其中,步骤①加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是除尽碳酸钠,防止对氢氧化钠的检验造成干扰;
Ⅲ.再取Ⅰ中得到的滤液少量,考虑滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成,故“原固体中一定含有NaCl”的结论不正确;
(二)定量探究:根据“沉淀全部溶解”的现象可确定白色沉淀的成分是CaCO3,则原固体中一定不含 BaSO4;其中,操作X将固体和液体分离,所以是过滤,通过(一)中分析,原固体中一定含有碳酸钠、氯化钙,不含氢氧化钠、硫酸铜、硫酸钡,所以当原固体加水后,无色滤液中一定含有的阳离子是Na+。