题目内容
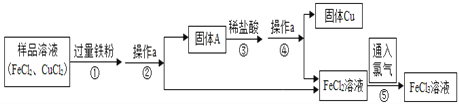
【题目】含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O的流程如下。

下列说法正确的是
A. 粉碎的目的是增大接触面积,加快反应速率,充分反应。
B. 溶液甲中共含有三种阳离子。
C. 物质X可以是铁,滤渣中含有的金属单质有铁和铜,除铜时发生的反应属于置换反应。
D. 流程中获得七水硫酸锌前省略的操作是:加热浓缩,冷却结晶,过滤,洗涤低温烘干。
【答案】AD
【解析】A、粉碎的目的是增大反应物接触面积,加快反应速率,使反应充分,正确;B、含锌废渣中加入过量稀硫酸后,氧化锌与硫酸反应生成硫酸锌和水,氧化亚铁与硫酸反应生成硫酸亚铁和水,氧化铜与硫酸反应生成硫酸铜和水,所以溶液甲中含有硫酸锌、硫酸铜、硫酸亚铁和过量的硫酸,溶液甲中共含有锌离子、铜离子、亚铁离子和氢离子四种阳离子,错误;C、物质X是铁,铁能和硫酸铜反应生成硫酸亚铁和铜,可以把硫酸铜除去,但是又引入亚铁离子,错误;D、流程中获得七水硫酸锌前省略的操作是加热条件下制成硫酸锌的饱和溶液、冷却结晶、过滤、洗涤和低温烘干,正确。故选AD。

【题目】小君和小英同学发现:带火星的竹签在空气中不会复燃,若用装有60%水的集气瓶倒置在水槽中收集氧气,得到的气体能使带火星的竹签复燃,为了找到能使带火星竹签复燃的氧气含量最小值,他们进行了如下探究:
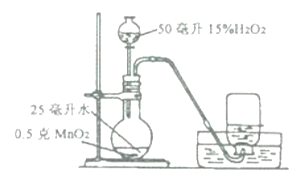
(设计实验)小君设计了如图的装置,该装置的圆底烧瓶中放入25毫升水的目的是____________。
(实验研究)第一组实验:取3只集气瓶,编号为①②③,分别装入15%30%和45%的水,盖上盖玻片倒置在水槽中。当气泡___________________放出后,导管口伸入集气瓶把其中的水全部排出,将相同的3支带火星竹签分别插入①~③号瓶中,记录实验现象。
获得第一组实验现象后,小君又做了第二组实验,并记录实验现象,两组实验数据和现象见下表:
实验分组 | 第一组 | 第二组 | ||||
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
集气瓶装水的体积分数/% | 15 | 30 | 45 | 34 | 38 | 42 |
带火星竹签状况 | 亮 | 很亮 | 复燃 | 很亮 | 复燃 | 复燃 |
得出上述两组实验现象后,小英认为还不能确定能使带火星竹签复燃的氧气含量最小值,需继续进行实验。则实验序号⑦的集气瓶装水的体积分数应该是_________%。
(实验结论)再经过数次实验并计算后得出:能使带火星竹签复燃的氧气含量最小值为48.7%。
(继续探究)小君认为采用该方法收集的氧气中含有一定量的水蒸气,请你提出实验改进的措施______________________。
【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)初步探究:Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含________________;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有______ |
取上层清液,滴加_____ | ________ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是________(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)深入探究:在老师的指导下同学们取原固体,进行如下实验:
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_______;其中,操作X的名称是______,无色滤液中一定含有的阳离子是____________。