题目内容
【题目】某化学小组对碳酸氢钠和碳酸钠的制备与性质产生兴趣,他们了解到下列化学史及相关信息:
I.我国化学家侯德榜在吕布兰法和索尔维法的基础上创立了先进的侯氏制碱法,基本消除废弃物的排放,同时生产NaHCO3和NH4Cl,请写出碳酸氢钠的一种用途:________。
II.索尔维法的原理:NaC1+NH3+CO2+H2O=NaHCO3↓+NH4Cl; 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
Ⅲ.氨气(NH3)是一种有刺激性气味、极易溶于水的碱性气体。
IV.Na2CO3与HCl的反应分步进行,首先发生反应:Na2CO3+HCl=NaHCO3+NaCl
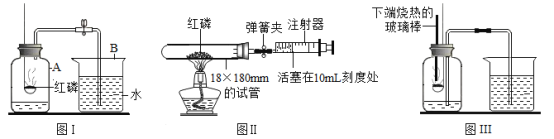
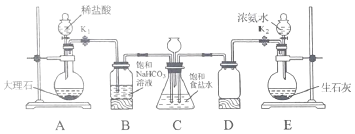
(实验目的)利用如图所示装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
(实验设计)
步骤1:关闭K1,打开K2使氨气进入装置C,调节气流速率,待装置C中气流平稳后,打开K1通入CO2。
步骤2:待装置C的锥形瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2。
步骤3:将锥形瓶内反应后的混合物过滤、洗涤、低温干燥,即得碳酸氢钠固体。
步骤4:将所得碳酸氢钠固体加热制取碳酸钠。
(表达交流)
(1)装置B中饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为________。
(2)装置C锥形瓶上连接的长颈漏斗的作用是____________(填序号)。
A 用于添加饱和食盐水 B 平衡气压 C 冷凝回流CO2
(3)步骤2中关闭K2停止通NH3后,还要继续通一段时间CO2,其目的是__________。
(4)步骤3中“低温干燥”的原因是____________________。
(反思评价)有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是________。
(延伸拓展)该小组继续探究碳酸钠的性质,向碳酸钠溶液中逐滴加入足量的稀盐酸,观察到:______。
【答案】用作发酵粉 NaHCO3+HCl=NaCl+H2O+CO2↑ B 使氨气充分反应 防止碳酸氢钠分解 防止氨气逸出污染环境 有气泡产生
【解析】
I
碳酸氢钠可用作发酵粉,可用于治疗胃酸过多等;
表达交流:
(1)氯化氢能与碳酸氢钠溶液反应生成氯化钠、水和二氧化碳,反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;
(2)长颈漏斗与外界空气相同,装置C锥形瓶上连接的长颈漏斗的作用是平衡气压。故选B;
(3)关闭K2停止通NH3后,还要继续通入一段时间CO2,其目的是形成酸性环境,利于使氨气充分反应;
(4)碳酸氢钠在加热的条件下会分解为碳酸钠、水和二氧化碳,为了防止碳酸氢钠分解,所以步骤3中要“低温干燥”;
反思评价:
氨气能与酸反应,在长颈漏斗内放置一团蘸有酸液的棉花,氨气极易溶于水并与酸反应,故能防止氨气逸出污染环境;
延伸拓展:
碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,所以观察到有气泡产生。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】如图是两种固体的溶解度曲线。
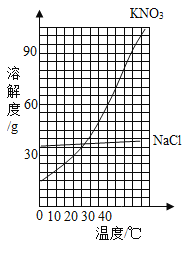
(1)40℃时,氯化钠的溶解度_________(填“>”、“=”或“<”)硝酸钾的溶解度。
(2)硝酸钾的溶解度随温度的升高而_____________。
(3)若将饱和的硝酸钾溶液从40℃降温到10℃,_____(填“有”或“无”)晶体析出。
(4)20℃时,某实验小组取不同质量的硝酸钾,分别加入到100g水中,充分溶解后,所得溶液的质量与加入硝酸钾的质量对应关系如表:
实验一 | 实验二 | 实验三 | 实验四 | |
硝酸钾的质量/g | 20.0 | 25.0 | 30.0 | 35.0 |
所得溶液的质量/g | 120.0 | 125.0 | 130.0 | 131.6 |
根据上表数据,实验二所得的溶液为__________(填“饱和”或“不饱和”)溶液;20℃时,硝酸钾的溶解度为_______g。