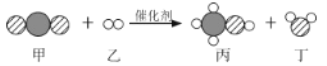
题目内容
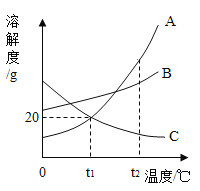
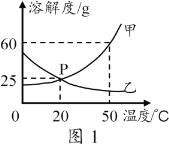
【题目】如图是两种固体的溶解度曲线。
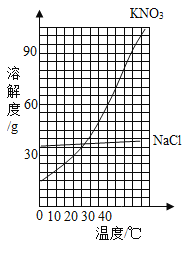
(1)40℃时,氯化钠的溶解度_________(填“>”、“=”或“<”)硝酸钾的溶解度。
(2)硝酸钾的溶解度随温度的升高而_____________。
(3)若将饱和的硝酸钾溶液从40℃降温到10℃,_____(填“有”或“无”)晶体析出。
(4)20℃时,某实验小组取不同质量的硝酸钾,分别加入到100g水中,充分溶解后,所得溶液的质量与加入硝酸钾的质量对应关系如表:
实验一 | 实验二 | 实验三 | 实验四 | |
硝酸钾的质量/g | 20.0 | 25.0 | 30.0 | 35.0 |
所得溶液的质量/g | 120.0 | 125.0 | 130.0 | 131.6 |
根据上表数据,实验二所得的溶液为__________(填“饱和”或“不饱和”)溶液;20℃时,硝酸钾的溶解度为_______g。
【答案】< 增大 有 不饱和 31.6
【解析】
(1)通过分析溶解度曲线可知,40℃时,氯化钠的溶解度<硝酸钾的溶解度;
(2)硝酸钾的溶解度随温度的升高而增大;
(3)硝酸钾的溶解度随温度的降低而减小,所以若将饱和的硝酸钾溶液从40℃降温到10℃,有晶体析出;
(4)通过分析上表数据,实验一、二、三中所加的硝酸钾完全溶解,实验四中所加的硝酸钾只溶解了31.6g,所以实验二所得的溶液为不饱和溶液;20℃时,硝酸钾的溶解度为31.6g。

 教材全解字词句篇系列答案
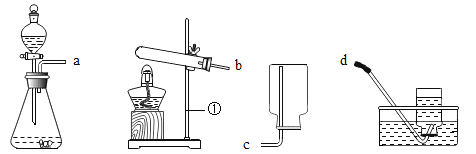
教材全解字词句篇系列答案【题目】实验室部分装置如图所示,请回答下列问题:
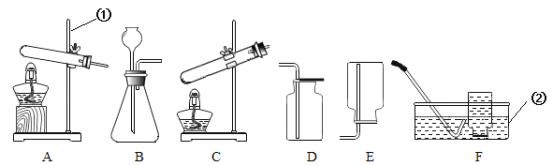
(1)写出标号仪器的名称:①_______________;②_____________。
(2)制取氧气有很多种方法,如分解过氧化氢溶液、加热高锰酸钾、_______等。
(3)采用分解过氧化氢溶液制取氧气有许多优点,如:______(填序号)。
①产物无污染 ②不需加热 ③需加热 ④生成物只有氧气
(4)选择发生和收集O2的装置,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
过氧化氢溶液、二氧化锰 | ________ | ___________ |
高锰酸钾 | _________ |
(5)如果用二氧化锰与浓硫酸加热制备O2,可选用的发生装置是______(填字母)。
(6)选用E装置收集气体时,下列实验操作正确的是________(填序号)。
①反应前,将集气瓶注满水,用玻璃片盖着瓶口,倒立在盛水的水槽中
②开始反应后,等到气泡连续且均匀时,再将导管口移入集气瓶
③收集气体后,将集气瓶盖上玻璃片再移出水槽
(7)实验室用高锰酸钾制备O2的文字表达式是________。