题目内容
【题目】实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题:
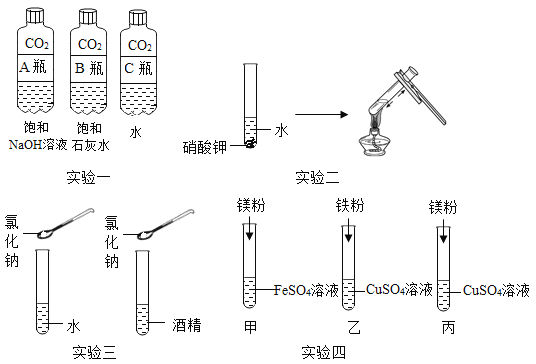
(活动与探究一)用对比实验方法探究二氧化碳的性质。
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为_____;对比A瓶与_____(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应。
(活动与探究二)用控制变量方法探究影响物质溶解性的因素。
(2)实验二目的是探究_____对硝酸钾溶解度的影响;实验三是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和_____。
(活动与探究三)探究镁、铁、铜三种金属的活动性顺序,设计了如图实验四的实验方案:
(3)试管乙中观察到的现象是_____,反应的化学方程式为_____。
(4)同学们经讨论后认为该方案可以优化,_____试管的实验是多余的。同学经讨论得出三种金属的活动性由强到弱的顺序为_____。
【答案】Ca(OH)2+CO2=CaCO3↓+H2O C 温度 溶质、溶剂的质量相等 铁表面有红色物质析出,溶液由蓝色变为浅绿色 Fe+CuSO4═FeSO4+Cu 丙 Mg>Fe>Cu
【解析】
(1)用对比实验方法探究二氧化碳的性质:实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生的反应是:二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C瓶的实验现象,可证明CO2能与NaOH发生反应;
(2)由实验二溶解硝酸钾,再加热可以比较温度变化对硝酸钾溶解度的影响,实验二目的是探究温度对硝酸钾溶解性的影响;实验三是探究溶剂种类对物质溶解性的影响,实验用了水、酒精2中不同的溶剂,该实验中需要控制的变量是温度和溶质、溶剂的质量相等;
(3)![]() 试管乙中铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,现象是铁表面有红色物质析出,溶液有蓝色变为浅绿色;反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
试管乙中铁与硫酸铜溶液反应生成铜和硫酸亚铁溶液,现象是铁表面有红色物质析出,溶液有蓝色变为浅绿色;反应的化学方程式为Fe+CuSO4═FeSO4+Cu;
![]() 甲、乙就可以证明三种金属的活动性强弱Mg>Fe>Cu,故丙是多余的;
甲、乙就可以证明三种金属的活动性强弱Mg>Fe>Cu,故丙是多余的;