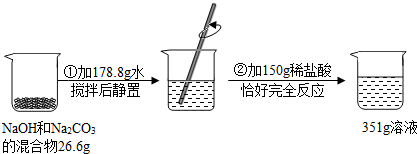
题目内容
草酸晶体(H2C2O4?2H2O)熔点较低,加热会熔化、气化和分解.草酸(H2C2O4)受热会分解,它与氢氧化钙的反应为:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O.
甲、乙两同学对草酸受热分解的产物作如下探究:
(1)猜想与假设:第一种:草酸分解生成CO2和H2;第二种:草酸分解生成CO2、CO和H2O;
第三种:草酸分解:H2C2O4→CO2↑+H2O(未配平);
有同学从理论上就可判断第三种假设不成立,老师也认为这一判断是正确的,该同学判断的理论依据是______.
(2)设计与实验:
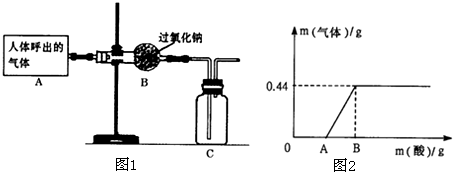
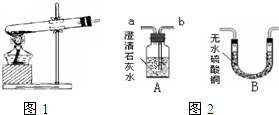
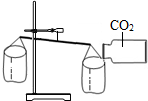
甲、乙两同学分别设计了下图所示的A、B两套实验装置(图中铁架台略去).
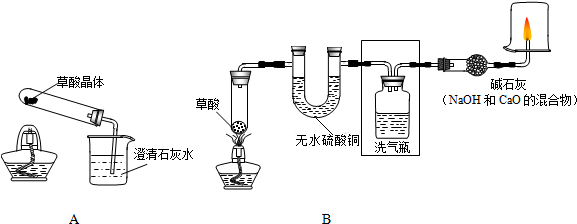
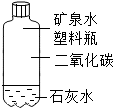
①甲同学按A装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断 不严密(填“严密”或“不严密”).
②乙同学的B装置图方框内的仪器未画完整,请你帮他画完整(直接画在图上或答题卡上).
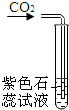
乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊.在尖嘴管口点燃剩余气体,火焰上方罩一个______烧杯,有白色固体生成,证明产物中有______;换一个干、冷烧杯罩在火焰上方,内壁无现象,证明产物中无H2.
(3)结论与思考:
①草酸受热分解的化学方程式为:______.
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步都反应完全),方法是:______.
甲、乙两同学对草酸受热分解的产物作如下探究:
(1)猜想与假设:第一种:草酸分解生成CO2和H2;第二种:草酸分解生成CO2、CO和H2O;
第三种:草酸分解:H2C2O4→CO2↑+H2O(未配平);
有同学从理论上就可判断第三种假设不成立,老师也认为这一判断是正确的,该同学判断的理论依据是______.
(2)设计与实验:
甲、乙两同学分别设计了下图所示的A、B两套实验装置(图中铁架台略去).

①甲同学按A装置实验,观察到澄清石灰水变浑浊,认为此现象是由草酸晶体受热分解产生的CO2所导致,此判断 不严密(填“严密”或“不严密”).
②乙同学的B装置图方框内的仪器未画完整,请你帮他画完整(直接画在图上或答题卡上).
乙同学按B装置实验,看到无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊.在尖嘴管口点燃剩余气体,火焰上方罩一个______烧杯,有白色固体生成,证明产物中有______;换一个干、冷烧杯罩在火焰上方,内壁无现象,证明产物中无H2.
(3)结论与思考:
①草酸受热分解的化学方程式为:______.
②若省略B装置方框内的仪器,整套装置也能证明产物中有CO2(假设每步都反应完全),方法是:______.
(共8分)
(1)酸受热分解若只生成二氧化碳和水,氢氧元素化合价不变,而碳元素化合价升高,所以反应后应有化合价降低的元素,所以(1)答案:(1)无法进行配平、配不平或不符合质量守恒定律或只有化合价的升高,无化合价的降低(1分).
(2)烧杯敞口放置在空气中空气中也有二氧化碳,时间长了烧杯内的澄清石灰水也会变浑浊,故答案:①不严密(1分)注意洗气瓶要长进短出,进气的导管要浸没液体中,出气导管只要刚刚露出橡皮塞.故答案②如右下图(长管不伸入液面下不给分,不作美观要求)(1分)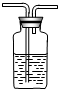
因为无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊,所以草酸受热分解肯定生成二氧化碳和水,但都被吸收.到最后点燃的是一氧化碳,燃烧生成二氧化碳.故答案:内壁附有澄清石灰水(其它合理答案均给分)(1分)CO(1分)
(3)根据实验现象和前面的分析知草酸受热分解生成二氧化碳、一氧化碳、水.故答案:①H2C2O4
CO2↑+CO↑+H2O(2分);
二氧化碳能和碱石灰中的氢氧化钠反应,虽没现象但干燥管因吸收它质量增加.故答案:②称量实验前后盛有碱石灰的干燥管的质量(意思相近的表述均给分)(1分)
(1)酸受热分解若只生成二氧化碳和水,氢氧元素化合价不变,而碳元素化合价升高,所以反应后应有化合价降低的元素,所以(1)答案:(1)无法进行配平、配不平或不符合质量守恒定律或只有化合价的升高,无化合价的降低(1分).
(2)烧杯敞口放置在空气中空气中也有二氧化碳,时间长了烧杯内的澄清石灰水也会变浑浊,故答案:①不严密(1分)注意洗气瓶要长进短出,进气的导管要浸没液体中,出气导管只要刚刚露出橡皮塞.故答案②如右下图(长管不伸入液面下不给分,不作美观要求)(1分)

因为无水硫酸铜由白变蓝,洗气瓶中溶液变浑浊,所以草酸受热分解肯定生成二氧化碳和水,但都被吸收.到最后点燃的是一氧化碳,燃烧生成二氧化碳.故答案:内壁附有澄清石灰水(其它合理答案均给分)(1分)CO(1分)
(3)根据实验现象和前面的分析知草酸受热分解生成二氧化碳、一氧化碳、水.故答案:①H2C2O4
| ||
二氧化碳能和碱石灰中的氢氧化钠反应,虽没现象但干燥管因吸收它质量增加.故答案:②称量实验前后盛有碱石灰的干燥管的质量(意思相近的表述均给分)(1分)

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目
| (20手0?新区二模)某化学兴趣小组有一次活动4内容是:对一包干燥4红色粉末组成进行探究.请你参与并回答有关问题. 教师提醒:它由Cu、Fe293、Fe(9H)3三种固体中4一种或两种组成. 提出猜想:红色粉末可能4组成有: ①只有Cu&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p;&nb6p; ②只有Fe293 ③只有Fe(9H)3 ④是Fe293、Fe(9H)34混合物 ⑤是Cu、Fe2934混合物&nb6p;&nb6p;&nb6p; ⑥是Cu、Fe(9H)34混合物 资料获悉:(手)2Fe(9H)3
(2)白色无水Cu694遇水变蓝 (3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu═2FeCl2+CuCl2 探究思路:利用物质4性质设计实验加以甄别,先分别探究其中是否含有Fe(9H)3、Cu等,逐步缩小范围,然后再选择适当4 试剂和方法,通过实验来探究其组成.(装置内空气中4水蒸气、C92忽略不计) 实验探究: (手)甲同学取适量红色粉末装入试管中,按图手进行实验.结果无水Cu694没有变蓝,从而排除猜想中4&nb6p;(填猜想中4序号). (2)在甲同学实验结论4基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色.乙同学认为可以排除猜想中4①和⑤,而丙同学认为只能排除猜想①,你认为&nb6p;4观点正确(填“乙”或“丙”). 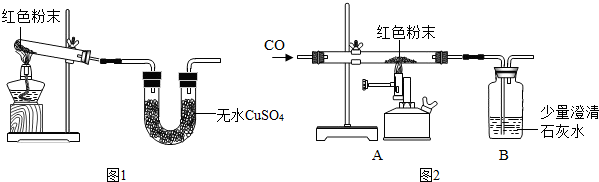 (3)丁同学为进一步确定红色粉末4组成,称取该粉末5.0g装入硬质玻璃管中,按图2在通风橱中进行实验.开始时缓缓通入C9气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通C9气体直至玻璃管冷却.反应前后称量相关装置和物质4总质量,其数据如y表:
(手)装置A中先通C9气体4作用是&nb6p;. (2)应该选择&nb6p;组4实验数据计算来确定红色粉末4组成.最终计算结果表明:该红色粉末4组成是猜想中4第&nb6p;组(填序号). (3)写出A装置中发生反应4化学方程式&nb6p;;实验中观察到A装置中4现象为&nb6p;. (4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B4连接处?&nb6p;(填“需要”或“不需要”),理由是&nb6p;. 反思评价:戊同学指出:从环保角度,图36-2装置有严重不足之处.你认为应该如何改进?&nb6p;. 拓展延伸:有同学提出丁同学上述实验中4C9还可以用H2代替,并将图36-2中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)4干燥管,来确定该红色粉末4组成,你认为是否可行?&nb6p;(填“可行”或“不可行”). |