题目内容
探究食品包装内的填充气.
【背景材料】
如图是市场充气包装的食品,细心的同学会发现它总是鼓鼓的,看上去像一个小“枕头”.它里面填充的是什么气体呢?某兴趣小组对此进行了研究.
【查阅资料】
(1)包装之所以鼓鼓的是为了使食品能够更新鲜、保质,同时还能防止食品挤压变形
(2)从经济性、环保等因素考虑,工厂使用的包装气体是空气或空气的成分之一.
【提出猜想】
猜想一:可能是氧气;依据是防止食品挤压变形.
猜想二:可能是二氧化碳;依据是防止食品挤压变形的同时还能延长保质期.
猜想三:可能是氮气,依据是______.
【设计实验】
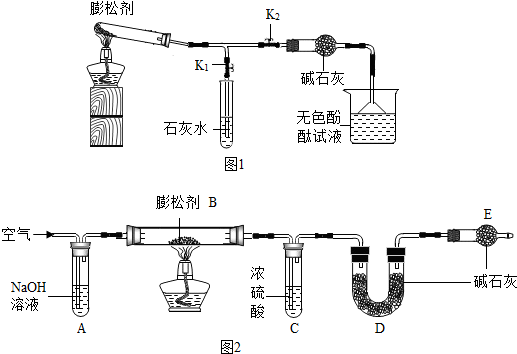
【反思与拓展】
(1)从获得气体的难易和经济性考虑,若只是为了防止食品挤压变形,最好使用的气体是:______.
(2)若要从能使食品更新鲜、保质和不易压碎等方面考虑,你认为食品充气包装对气体的要求是______、______(写出两点)

【背景材料】
如图是市场充气包装的食品,细心的同学会发现它总是鼓鼓的,看上去像一个小“枕头”.它里面填充的是什么气体呢?某兴趣小组对此进行了研究.
【查阅资料】
(1)包装之所以鼓鼓的是为了使食品能够更新鲜、保质,同时还能防止食品挤压变形
(2)从经济性、环保等因素考虑,工厂使用的包装气体是空气或空气的成分之一.
【提出猜想】
猜想一:可能是氧气;依据是防止食品挤压变形.
猜想二:可能是二氧化碳;依据是防止食品挤压变形的同时还能延长保质期.
猜想三:可能是氮气,依据是______.
【设计实验】
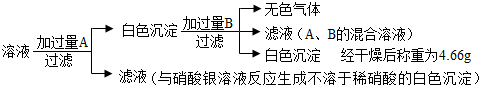
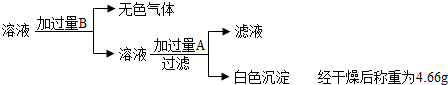
| 实验操作 | 实验现象 | 实验结论 |
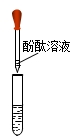
| ①用注射器将包装袋内的气体抽出,将其注入澄清石灰水中 | ______ | 猜想二错误 |
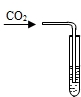
| ②用注射器将包装袋内的气体抽出,用排水法收集于集气瓶中,将燃着的木条伸入集气瓶内,观察其燃烧情况 | 燃着的木条熄灭 | 说明猜想______错误,由此推知包装袋内的气体是______ |
(1)从获得气体的难易和经济性考虑,若只是为了防止食品挤压变形,最好使用的气体是:______.
(2)若要从能使食品更新鲜、保质和不易压碎等方面考虑,你认为食品充气包装对气体的要求是______、______(写出两点)

【提出猜想】
猜想三:可能是氮气,依据是 防止食品挤压变形的同时还能延长保质期.
【设计实验】
【反思与拓展】
(1)从获得气体的难易和经济性考虑,若只是为了防止食品挤压变形,最好使用的气体是:空气;
(2)因为是防止食品变质,所以所充气体首先应具备无毒、不和食品反应,从经济角度尽量选廉价气体.
故答案为:【提出猜想】防止食品挤压变形的同时还能延长保质期
【设计实验】①澄清石灰水无变化;②一;氮气
【反思与拓展】(1)空气;(2)无毒、与食品不反应、价廉易得等(合理均可)
猜想三:可能是氮气,依据是 防止食品挤压变形的同时还能延长保质期.
【设计实验】
| 实验操作 | 实验现象 | 实验结论 |
| ①用注射器将包装袋内的气体抽出,将其注入澄清石灰水中 | 澄清石灰水无变化 | 猜想二错误 |
| ②用注射器将包装袋内的气体抽出,用排水法收集于集气瓶中,将燃着的木条伸入集气瓶内,观察其燃烧情况 | 燃着的木条熄灭 | 说明猜想 一错误,由此推知包装袋内的气体是 氮气 |
(1)从获得气体的难易和经济性考虑,若只是为了防止食品挤压变形,最好使用的气体是:空气;
(2)因为是防止食品变质,所以所充气体首先应具备无毒、不和食品反应,从经济角度尽量选廉价气体.
故答案为:【提出猜想】防止食品挤压变形的同时还能延长保质期
【设计实验】①澄清石灰水无变化;②一;氮气
【反思与拓展】(1)空气;(2)无毒、与食品不反应、价廉易得等(合理均可)

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目