题目内容
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
(查得资料)
(1)该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
(2)饱和碳酸氢钠溶液不吸收二氧化碳。
(3)碱石灰的主要成分为氧化钙和氢氧化钠。
(设计实验)小组同学设计了如图所示装置(图中夹持仪器略去)测定牙膏样品中碳酸钙的含量。
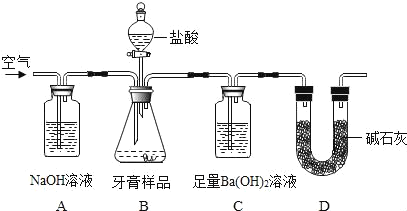
依据图示回答下列问题:
(1)B装置使用分液漏斗的优点是_____。
(2)A中氢氧化钠溶液的作用是_____。
(3)C中观察到有沉淀产生,反应的化学方程式为_____。
(4)实验过程中需持续缓缓通入空气,其作用有_____。
(解释与结论)将C中产生沉淀通过_____、洗涤、干燥、称量,通过计算求得牙膏样品中碳酸钙的含量。
(反思与评价)
反思实验过程,小刚同学提出应采取必要措施,提高测定准确度。他提出的下列各项措施中,不能提高测定准确度的是_____(填字母序号)。
a 在加入盐酸之前,排净装置内的CO2气体
b 放慢滴加盐酸的速度
c 在A﹣B之间增添盛有浓硫酸的洗气装置
d 在B﹣C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(拓展延伸)小亮同学为确定A中溶质成分,进行了如表所示实验:
实验操作 | 实验现象 | 实验结论 |
(1)、取少量滤液于试管中,加入足量____ | 产生白色沉淀 | 溶质主要成分为Na2CO3和NaOH |
(2)、过滤,取少量滤液加入 | _____ |
【答案】能够控制反应速率 吸收空气中的二氧化碳 Ba(OH)2+CO2═BaCO3↓+H2O 使反应生成的二氧化碳气体全部被氢氧化钡溶液吸收 过滤 cd 氯化钙溶液(合理即可) 酚酞试液变红色(合理即可)
【解析】
设计实验:
(1)B装置使用分液漏斗的优点是:通过分液漏斗可以控制液体药品的流量,从而可以控制反应速率;
(2)氢氧化钠能和二氧化碳反应生成碳酸钠和水。A中氢氧化钠溶液的作用是吸收空气中的二氧化碳;
(3)C中观察到有沉淀产生,是因为氢氧化钡和二氧化碳反应生成了碳酸钡沉淀和水,反应的化学方程式为:Ba(OH)2+CO2═BaCO3↓+H2O;
(4)实验过程中需持续缓缓通入空气,其作用有使反应生成的二氧化碳气体全部被氢氧化钡溶液吸收,提高实验结果准确性;
解释与结论:
本实验中可通过C中反应生成的碳酸钡的质量计算碳酸钙的含量。将C中产生沉淀通过过滤、洗涤、干燥、称量,通过计算求得牙膏样品中碳酸钙的含量;
反思与评价:
a 在加入盐酸之前,排净装置内的CO2气体,能够防止装置中的二氧化碳对实验的影响,从而使实验结果更准确;
b 放慢滴加盐酸的速度,能使反应速率减慢,从而使二氧化碳被氢氧化钡溶液充分吸收,使实验结果更准确;
c 在A﹣B之间增添盛有浓硫酸的洗气装置,能够除去水蒸气,但是通过B装置使又带出水蒸气,无论气体中是否含有水蒸气,都不影响实验结果;
d.在B﹣C之间增添盛有饱和碳酸氢钠溶液的洗气装置时,碳酸氢钠能和稀盐酸中挥发出的氯化氢反应生成氯化钠、水和二氧化碳,使二氧化碳质量增加,会导致实验结果偏大。故选cd;
拓展延伸:
若溶质主要成分为Na2CO3和NaOH, 碳酸钠溶液和氢氧化钠溶液都是显碱性溶液,都能使酚酞试液变红色,碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,所以在检验时,选用过量的氯化钙溶液检验碳酸钠,并完全除去碳酸钠,再用酚酞检验氢氧化钠。实验过程如下所示:
实验操作 | 实验现象 | 实验结论 |
1、取少量滤液于试管中,加入足量氯化钙溶液 | 产生白色沉淀 | 溶质主要成分为Na2CO3和NaOH |
2、过滤,取少量滤液加入酚酞试液 | 酚酞试液变红色 |

【题目】水是生命活动中的重要物质.
(1)下表为某品牌营养素饮料标签的部分内容,请根据表中信息回答问题.
营养成分 | 糖类 | 钠 | 钙 | 锌 | 维生素C | 维生素B6 |
含量/500mL | 22.5g | 16mg | 16mg | 3.0mg | 100mg | 0.56mg |
该饮料含有六大营养素中的_____种;该饮料中的_____元素对预防青少年佝偻病有益;该饮料pH为3.5,此饮料呈_____性(填“酸”、“碱”或“中”).
(2)如图为电解水的实验装置,负极产生的气体是_____,该反应的化学方程式为_____.

(3)保护水资源是每个公民应尽的责任和义务.下列防止水污染的措施可行的是_____.
A抑制水中所有动植物生长 B不任意排放工业废水
C禁止使用农药和化肥 D生活污水处理后再排放.
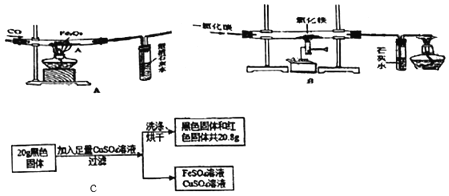
【题目】杨敏在实验室进行CO还原氧化铁的实验采用酒精灯加热(图A)与书本实验(图B)现象相同,发现在得到的黑色粉末中加稀盐酸,没有气泡产生,杨敏就图A实验中反应后得到的黑色粉末的成分进行了如下探究。
(查阅资料)①铁粉及铁的几种常见氧化物的颜色及部分性质。
物质 | 铁粉 | Fe2O3 | Fe3O4 | FeO |
颜色 | 黑色 | 红棕色 | 黑色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 能 | 不能 |
②实验室酒精灯的温度为400﹣500℃,酒精喷灯的加热温度在1000℃左右。
③当温度高于300℃以上,Fe2O3容易被还原成Fe3O4;当温度高于600℃以上,Fe3O4容易被还原FeO;当温度高于700℃以上,FeO容易被还原成Fe;
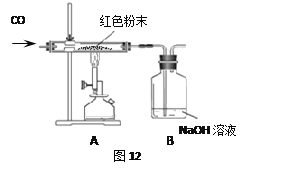
(提出问题)图A实验得到黑色粉末的成分是什么?
(提出猜想)黑色粉末的成分是:①FeO、Fe3O4②FeO③Fe3O4;④FeO、Fe3O4、Fe2O3。
(分析与评价)猜想_____错误,理由是_____。
(1)装置A有一处明显错误,该错误是_____。
(2)请写出澄清石灰水中发生的反应的化学方程式_____。
(3)由对比实验可知,还原氧化铁的实验产物与_____有关。
(实验设计)将图A实验得到黑色粉末倒在一表面皿中,用磁铁接触黑色粉末,出现_____现象,说明猜想②正确。
(4)实验B最后得到的黑色固体可能是Fe和Fe3O4,中的一种或两种。小海设计如下实验探究其成分,请帮助他完成该探究过程。
(探究过程)①定性研究:取少量的图B实验得到的黑色粉末于一试管中,加入适量的硫酸铜溶液,充分振荡,出现_____现象,证明黑色固体中有铁。
②定量研究:取B实验得到的黑色固体20g,设计如图C实验:试推测黑色固体的成分是_____。
③有同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应)_____(填“行”或“不行”)理由是_____。