题目内容
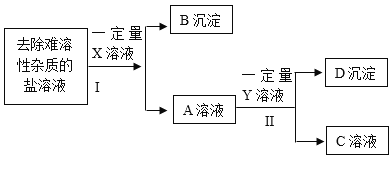
【题目】小明除去粗盐中不溶性杂质后,采用如下流程进一步除去粗盐中的可溶性杂质氯化镁、氯化钙、硫酸钠。在操作的过程中由于粗心,小明只确定所加入的X溶液是氯化钡溶液,而Y和Z溶液不确定分别是碳酸钠溶液和氢氯化钠溶液中的哪一种,且X. Y. Z所用的量也不确定。
请回答下列问题:
(1)加入X溶液后发生反应的化学方程式是_________________。
(2)小明取适量D沉淀于烧杯中加入足量的稀盐酸,观察到_________________,确定Y溶液是氢氧化钠溶液。
(3)小明为了确定粗盐中的可溶性杂质是否完全除干净以及所加入溶液是否还有剩余,对E溶液成分进行检验与分折,设计实验方案如下:
实验操作步骤 | 实验现象 | 实验结论 |
步骤一:取少量E溶液于试管中加入足量氯化钡溶液,过滤,向沉淀中加入过量稀硝酸 | 产生白色沉淀; 沉淀部分溶解 | 证明 E溶液中含有的物质是 ① _____________,没有的是 ②____________ |
步骤二:向步骤一反应后所得滤液中加入③____________溶液 | 观察到: ④_________________ | 证明滤液中含有NaOH,则没有的物质是⑤_______________ |
[总结归纳]为了完全除去粗盐中的可溶性杂质,所加入的反应物要_________________。
[拓展延伸]在除去粗盐中可溶性杂质的过程中。小亮认为若实验室中没有氯化钡溶液可以用____________溶液来替换。
【答案】Na2SO4+BaCl2=BaSO4↓+2NaCl 固体溶解,且没有气体生成 Na2CO3、Na2SO4 CaCl2、BaCl2 酚酞试液 溶液变红色 MgCl2 足量或过量 氢氧化钡
【解析】
(1)氯化钡会和硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式为,Na2SO4+BaCl2=BaSO4↓+2NaCl,故填:Na2SO4+BaCl2=BaSO4↓+2NaCl。
(2)加入氢氧化钠,氯化镁和氢氧化钠生成氯化钠和氢氧化镁沉淀,氢氧化镁沉淀加稀盐酸生成氯化镁和水,固体溶解,且没有气体生成,加入碳酸钠,碳酸钠和氯化钙生成碳酸钙沉淀和氯化钠,碳酸钙沉淀加盐酸生成氯化钙二氧化碳和水,固体溶解,且有气体生成,固体溶解,且没有气体生成说明加入的是氢氧化钠,故填:固体溶解,且没有气体生成。
(3)碳酸钠和氯化钡生成碳酸钡沉淀,硫酸钠和氯化钡生成硫酸钡沉淀,步骤一:取少量E溶液于试管中加入足量氯化钡溶液,过滤,向沉淀中加入过量稀硝酸,沉淀部分溶解,说明滤液中既有碳酸钠又有硫酸钠,碳酸钠和氯化钙、氯化钙反应不能共存,滤液中一定没有氯化钙、氯化钡,步骤二:向步骤一反应后所得滤液中加入酚酞溶液,观察到溶液变红色,证明滤液中含有NaOH,氢氧化钠和氯化镁不共存,则没有的物质是氯化镁,故填:Na2CO3、Na2SO4;CaCl2、BaCl2;酚酞试液;溶液变红色;MgCl2。
[总结归纳]为了完全除去粗盐中的可溶性杂质,所加入的反应物要足量或过量,故填:足量或过量。
[拓展延伸]在除去粗盐中可溶性杂质的过程中。若实验室中没有氯化钡溶液可以用氢氧化钡溶液来替换。因为氢氧化钡可以去除硫酸钠生成硫酸钡沉淀和氢氧化钠,氢氧化钠又可以去除氯化镁生成氢氧化镁沉淀,故填:氢氧化钡。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】化学实验探究总是能引起同学们的兴趣。某化学兴趣小组在实验室实验时发现了一瓶标签缺损的溶液,如下图。为了确认其溶质成分,同学们进行了如下探究:
(提出猜想)猜想一:NaCl; 猜想二:Na2CO3;猜想三: NaHCO3 猜想四:NaOH
(设计实验一)
小明取少量溶液样品于试管中,用玻璃棒蘸取溶液滴在pH试纸上,读取数据,pH=9,得出结论,猜想四成立。
小王认为小明的结论不准确,理由是:________________。
从小明的实验结果中可以判断出猜想_________也一定是错误的。
(设计实验二)小红取适量稀盐酸于试管中,滴加少量此溶液,溶液中产生气泡。于是认为猜想二正确。
小王认为仍然不能确定,理由是_______________。
(查阅资料)常温下,碳酸钠和碳酸氢钠的溶解度为以下表格中的数据。
Na2CO3 | NaHCO3 | |
溶解度/g | 21.8 | 9.6 |
(分析结论)从资料显示的数据,再结合药品的标签,可以判断猜想_________不正确,理由是_____________________。
(问题交流)(1)Na2CO3和 NaHCO3在生活中被称为“苏打兄弟”,其中NaHCO3在生活中可用来_______________ (写出一条即可)。
(2)Na2CO3在空气中长期放置,会吸收空气中水蒸气和另一种气体而转变成 NaHCO3。请你写出反应方程式________________________。
[注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。]
兴趣小组和老师一起继续实验,将盐酸滴加到Na2CO3溶液中进行反应,并用数字化实验装置pH传感器测定了溶液中pH的变化。采集数据得到曲线如下图所示。
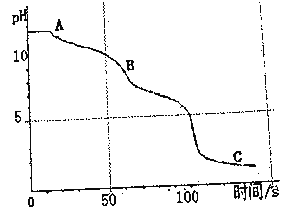
(3)0-50s时,同学们观察到溶液中并没有想象中的气泡产生,请你写出AB段发生反应的化学方程式:__________________。
(4)B点溶液pH大于7,是因为___________(填物质名称)的水溶液呈碱性。
(5)C点所得溶液的溶质是__________________。
【题目】镁条在空气中剧烈燃烧,发出耀眼的白光,生成白色固体,细心的小明同学发现,镁条燃烧除生成白色固体外,还有少量的淡黄色固体生成,经查阅资料得知:淡黄色固体是由镁条和空气中的氮气化合产生的,写出该反应的化学方程式__,产生的白色固体比淡黄色固体多的原因是__。他还发现镁条在空气中久置表面会变黑,实验小组同学设计并进行实验,探究镁条变黑的条件。
[猜想假设]常温下,镁条变黑可能与O2、CO2、水蒸气有关。
[查阅资料]常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
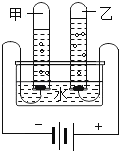
[设计实验]通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL) ,分别进行下列5个实验,并持续观察20天。

实验操作 | 实验现象 |
1.先充满用NaOH浓溶液洗涤过的空气,再加人2mL浓硫酸 | 镁条始终无明显变化 |
2.加人NaOH浓溶液 | 镁条始终无明显变化 |
3.先加人2mL浓硫酸,再通入约4mLCO2 | 镁条始终无明显变化 |
4.先加入4mL饱和Na2SO3溶液,再充满CO2 | 镁条始终无明显变化 |
5.先加入2mL蒸馏水,再通入约4mL CO2 | 镁条第3天开始变黑,至第20天全部变黑 |
[解释与结论]①实验1的目的是_;②实验3中,试管内气体主要含CO2和__;③得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___(填序号);④由上述实验可知,镁条变黑的条件是__。
[反思与评价]①在猜想假设时,同学们认为镁条变黑与N2无关,理由是_____;
②实验1和实验2中,NaOH浓溶液的作用是__;③欲进一步证明镁条表面的黑色物质中含有碳酸盐,你的实验方案是__。