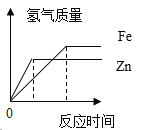
题目内容
【题目】金属制品和金属材料生活中随处可见,学习应用金属的性质尤其重要。
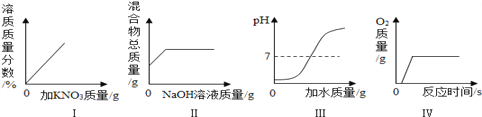
Ⅰ.下图为某学习小组探究金属化学性质时所做的四个实验,仔细分析后回答下列问题:
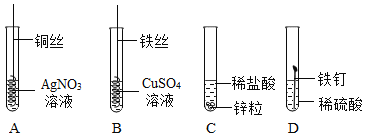
(1)描述 A 中的实验现象_________。
(2)写出 C 中反应的化学方程式_______。
(3)要证明 Cu、Fe、Ag 的活动性顺序,至少要做的实验是________(填序号)。
(4)开始反应后 D 中溶液逐渐变为黄色,原因是_________(化学方程式)。
Ⅱ.赤铁矿冶炼铁的化学方程式为________。
【答案】有银白色固体析出,溶液由无色变为蓝色 ![]() AB
AB ![]()

【解析】
Ⅰ、(1)A中铜与硝酸银反应生成硝酸铜和银,故实验现象为:有银白色固体析出,溶液由无色变为蓝色;
(2)C中锌与稀盐酸反应生成氯化锌和氢气,该反应的化学方程式为:![]() ;
;
(3)A、铜能与硝酸银反应生成硝酸铜和银,有银白色固体析出,说明在金属活动性顺序里,铜位于银之前;
B、铁能与硫酸铜反应生成硫酸亚铁和铜,有红色固体析出,说明在金属活动性顺序里,铁位于铜之前;
C、锌能与稀盐酸反应生成氯化锌和氢气,有气泡产生,说明在金属活动性顺序里,锌位于氢之前;
D、铁能与稀硫酸反应生成硫酸亚铁和氢气,有气泡产生,说明在金属活动性顺序里,铁位于氢之前。
故要证明 Cu、Fe、Ag 的活动性顺序,至少要做的实验是AB;
(4)开始反应后 D 中溶液逐渐变为黄色,说明铁钉已经生锈,铁锈的主要成分是三氧化二铁,三氧化二铁能与稀硫酸反应生成硫酸铁和水,该反应的化学方程式为:![]() ;
;
Ⅱ、赤铁矿的主要成分是三氧化二铁,三氧化二铁能与一氧化碳在高温的条件下反应生成铁和二氧化碳,该反应的化学方程式为: 。
。

【题目】小明除去粗盐中不溶性杂质后,采用如下流程进一步除去粗盐中的可溶性杂质氯化镁、氯化钙、硫酸钠。在操作的过程中由于粗心,小明只确定所加入的X溶液是氯化钡溶液,而Y和Z溶液不确定分别是碳酸钠溶液和氢氯化钠溶液中的哪一种,且X. Y. Z所用的量也不确定。
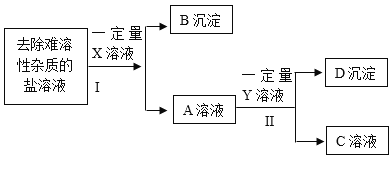
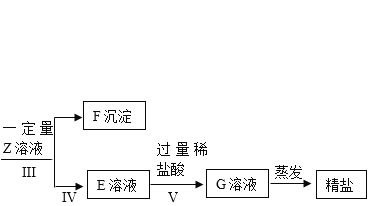
请回答下列问题:
(1)加入X溶液后发生反应的化学方程式是_________________。
(2)小明取适量D沉淀于烧杯中加入足量的稀盐酸,观察到_________________,确定Y溶液是氢氧化钠溶液。
(3)小明为了确定粗盐中的可溶性杂质是否完全除干净以及所加入溶液是否还有剩余,对E溶液成分进行检验与分折,设计实验方案如下:
实验操作步骤 | 实验现象 | 实验结论 |
步骤一:取少量E溶液于试管中加入足量氯化钡溶液,过滤,向沉淀中加入过量稀硝酸 | 产生白色沉淀; 沉淀部分溶解 | 证明 E溶液中含有的物质是 ① _____________,没有的是 ②____________ |
步骤二:向步骤一反应后所得滤液中加入③____________溶液 | 观察到: ④_________________ | 证明滤液中含有NaOH,则没有的物质是⑤_______________ |
[总结归纳]为了完全除去粗盐中的可溶性杂质,所加入的反应物要_________________。
[拓展延伸]在除去粗盐中可溶性杂质的过程中。小亮认为若实验室中没有氯化钡溶液可以用____________溶液来替换。