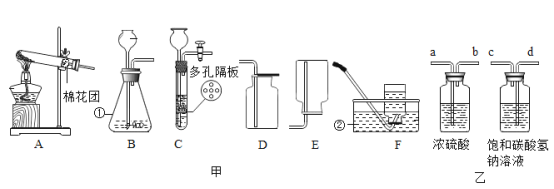
题目内容
【题目】元素周期表是学习和研究化学的重要工具。
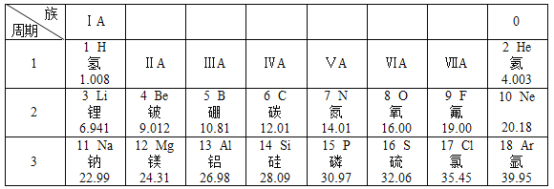
请分析图中信息回答相关问题:
(1)上述表中地壳含量最多的元素是____________(填元素符号), 该元素原子的核电荷数为______ ,该元素的原子在化学反应中容易______________(填“得”或“失”)电子。
(2)氯原子和氩原子化学性质不同的原因是_____________________。
(3) 14元素形成的氧化物化学式是_____________________。
【答案】O 8 得 最外层电子数不同 SiO2
【解析】
(1)上述表中地壳含量最多的元素是O,该元素原子的核电荷数为8,该元素的原子最层电子数为6大于4,在化学反应中容易得电子,故填:O;8;得。
(2)最外层电子数相同,化学性质相识,氯原子和氩原子化学性质不同的原因是最外层电子数不同,故填:最外层电子数不同。
(3)14号元素是硅元素,化合价为+4价,根据化合价代数和为零氧化物的化学式为SiO2,故填:SiO2。

【题目】小明除去粗盐中不溶性杂质后,采用如下流程进一步除去粗盐中的可溶性杂质氯化镁、氯化钙、硫酸钠。在操作的过程中由于粗心,小明只确定所加入的X溶液是氯化钡溶液,而Y和Z溶液不确定分别是碳酸钠溶液和氢氯化钠溶液中的哪一种,且X. Y. Z所用的量也不确定。
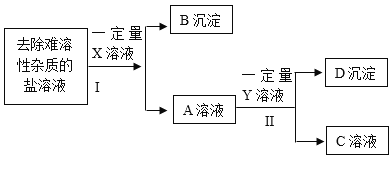
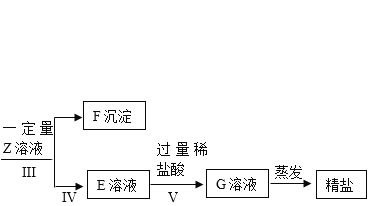
请回答下列问题:
(1)加入X溶液后发生反应的化学方程式是_________________。
(2)小明取适量D沉淀于烧杯中加入足量的稀盐酸,观察到_________________,确定Y溶液是氢氧化钠溶液。
(3)小明为了确定粗盐中的可溶性杂质是否完全除干净以及所加入溶液是否还有剩余,对E溶液成分进行检验与分折,设计实验方案如下:
实验操作步骤 | 实验现象 | 实验结论 |
步骤一:取少量E溶液于试管中加入足量氯化钡溶液,过滤,向沉淀中加入过量稀硝酸 | 产生白色沉淀; 沉淀部分溶解 | 证明 E溶液中含有的物质是 ① _____________,没有的是 ②____________ |
步骤二:向步骤一反应后所得滤液中加入③____________溶液 | 观察到: ④_________________ | 证明滤液中含有NaOH,则没有的物质是⑤_______________ |
[总结归纳]为了完全除去粗盐中的可溶性杂质,所加入的反应物要_________________。
[拓展延伸]在除去粗盐中可溶性杂质的过程中。小亮认为若实验室中没有氯化钡溶液可以用____________溶液来替换。
【题目】NH4C1和Na2SO4的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4C1 | 3.33 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
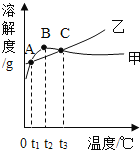
A.甲为NH4C1的溶解度曲线
B.两种物质的溶解度均随温度升高而增大
C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D.等质量的甲、乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,加入的甲、乙固体质量相等