题目内容
【题目】某化学社团的同学发现,不同物质的变化常伴随着相同的实验现象。但从化学的角度去研究,会发现其有本质的区别。

【现象分析】
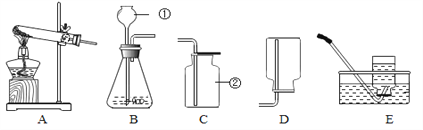
实验一:向盛有一定量氢氧化钠固体的试管里加入一定量的水,迅速用带导管的橡皮塞塞紧试管口,并将导管另一端通入盛有水的试管中,振荡左侧试管(如右图)。
实验二:用氧化钙代替氢氧化钠重复一次上述实验。
上述两个实验的相同现象之一是__________;
上述两个实验中,其中一个实验发生了化学变化,其化学方程式是__________;另一个实验没有发生化学变化。
【本质归纳】相同的实验现象,既可以由物理变化引起,也可以由化学变化引起。
【探究运用】在探究白色粉末的组成时,要研究相同实验现象的本质区别。
实验三:有一包白色粉末可能含有硫酸钡、碳酸钠和氢氧化钙中的一种或几种,取一定量该粉末加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物。
小奇同学查阅资料,得出碳酸钠的水溶液显___________(填“酸性”、“中性”或“碱性”)。
小明同学认为,白色粉末中一定含有硫酸钡;
小意同学认为小明的结论不准确,其理由是________________________________。
针对上述两位同学的观点,小燕同学进一步设计如下实验方案进行探究:

(1)步骤②中发生化学反应的方程式是_________________________________;
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,则原白色粉末的组成是________(填化学式,下同);步骤③中,加入酚酞溶液后,若溶液E为红色,则滤液A中一定含有的溶质是_________。
(3)小鹏同学只做了一个实验,他取少量滤渣B,加入过量的稀硝酸,观察到___________现象,说明原白色粉末中含有碳酸钠、氢氧化钙二种固体。
(4)小鹏同学为进一步测定白色粉末的组成,进行了定量研究。他称取白色固体粉末10g,进行如流程所示实验,测得滤渣B的质量为5g,请你帮小鹏计算一下白色粉末中各成分的质量为________。(请写出具体计算过程)
【答案】 右侧导管口有气泡 CaO+H2O=Ca(OH)2 碱性 碳酸钠和氢氧化钙在溶液中反应也会生成沉淀(或者写方程式) Na2CO3+CaCl2=CaCO3↓+2NaCl Na2CO3 BaSO4 Na2CO3 NaOH 滤渣(固体)全部消失 碳酸钠6.3g,氧氧化钙3.7g
【解析】本题考查了混合物组成的推断,完成此题,可以根据物质的性质,结合题文提供的实验现象及反应的具体现象进行分析。
实验二:氢氧化钠溶于水放出热量,氧化钙与水反应会放出热量,试管内的气体受热膨胀。观察到右侧试管的导管口处有气泡冒出;氢氧化钠溶于水属于物理变化,而氧化钙与水反应生成氢氧化钙属于化学变化,化学方程式为:CaO+H2O=Ca(OH)2;
实验三:碳酸钠的水溶液显碱性;小意同学认为小明的结论不准确,其理由是碳酸钠和氢氧化钙在溶液中反应也会生成沉淀;
(1)步骤②中发生化学反应是碳酸钠与氯化钙溶液反应生成氯化钠和碳酸钙白色沉淀,反应的化学方程式是a2CO3+CaCl2=CaCO3↓+2NaCl;
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,说明反应后的溶液呈中性,也就是说碳酸钠被完全转化为沉淀,而原混合物中不含氢氧化钙,所以原白色粉末的组成是:Na2CO3 BaSO4;步骤③中加入酚酞溶液后,若溶液E为红色,说明原混合物中有氢氧化钙,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠.根据后面加入氯化钙后产生白色沉淀说明碳酸钠较多,所以滤液A中一定含有的溶质是:Na2CO3 NaOH;
(3)白色沉淀可能是硫酸钡,也可能是碳酸钡,也可能是硫酸钡与碳酸钡的混合物,其中硫酸钡不与稀硝酸反应,碳酸钡与稀硝酸反应生成硝酸钡、水和二氧化碳。小鹏同学只做了一个实验,他取少量滤渣B,加入过量的稀硝酸,观察到滤渣(固体)全部消失现象,说明原白色粉末中含有碳酸钠、氢氧化钙二种固体;
(4)设:混合物中含有氢氧化钙质量为x
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 74 100
x 5g
![]() x=3.7g,碳酸钠质量=10g-3.7g=6.3g。白色粉末中各成分的质量分别为:碳酸钠6.3g,氧氧化钙3.7g。
x=3.7g,碳酸钠质量=10g-3.7g=6.3g。白色粉末中各成分的质量分别为:碳酸钠6.3g,氧氧化钙3.7g。

 优等生题库系列答案
优等生题库系列答案【题目】为测定某铜锌合金中锌的含量,取50g样品进行实验,将l00g稀盐酸分五次加入该样品中(杂质不溶于水也不参与反应,反应原理为:Zn+2HCl=ZnCl2+H2↑),充分反应后测得生成气体的总质量如表所示:
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.05 | 0.10 | m | 0.20 | 0.20 |
试求:(1)m的数值为___________。
(2)该铜锌合金中锌的质量分数是___________?(写出计算过程)