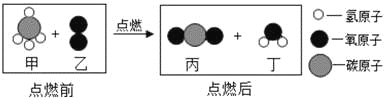
题目内容
【题目】在化学上常用燃烧法测定有机物的组成。现取3.2 g某有机物在足量氧气中充分燃烧,生成4.4 g CO2和3.6 gH2O,则该有机物中( )
A. 一定含有C、H两种元素,可能含有O元素
B. 一定含有C、H、O 三种元素
C. 一定含有C、O 两种元素,可能含有H元素
D. 只含有C、H 两种元素,不含O元素
【答案】B
【解析】4.4g二氧化碳中碳元素的质量为:4.4g×![]() ×100%=1.2g,氧元素的质量为:4.4g-1.2g=3.2g;3.6g水中氢元素的质量为:3.6g×
×100%=1.2g,氧元素的质量为:4.4g-1.2g=3.2g;3.6g水中氢元素的质量为:3.6g×![]() ×100%=0.4g,氧元素的质量为:3.6g-0.4g=3.2g;二氧化碳中的碳元素和水中的氢元素来自于该有机物,该有机物中氧元素的质量为:3.2g-1.2g-0.4g=1.6g,因此该有机物中含有碳元素、氢元素和氧元素。故选B。
×100%=0.4g,氧元素的质量为:3.6g-0.4g=3.2g;二氧化碳中的碳元素和水中的氢元素来自于该有机物,该有机物中氧元素的质量为:3.2g-1.2g-0.4g=1.6g,因此该有机物中含有碳元素、氢元素和氧元素。故选B。

【题目】某化学学习小组的同学做实验,向盛有少量氢氧化钠溶液的试管中通入二氧化碳,未看到明显的实验现象。
(提出问题)氢氧化钠能否与二氧化碳反应?
(猜想与假设)甲同学认为氢氧化钠能与二氧化碳反应;乙同学认为氢氧化钠不能与二氧化碳反应。
(设计与实验)甲同学设计了下图所示的两个装置进行实验,请你和他一起验证他的猜想。
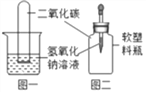
实验步骤 | 实验现象 | 实验结论 |
如图一,将收集满二氧化碳的试管倒置于氢氧化钠溶液中 | _________ | 二氧化碳和氢氧化钠发生了反应 |
如图二,将滴管中的氢氧化钠溶液滴入集满二氧化碳的软塑料瓶中 | ________ |
(反思与评价)对此乙同学提出质疑,认为上述现象可能是二氧化碳溶于水的结果。
(设计与实验)请你利用检验上述软塑料瓶中反应后生成物的方法,设计一个实验证明氢氧化钠确实与二氧化碳发生了反应。
实验步骤 | 实验现象 | 实验结论 |
________ | ________ | 氢氧化钠与二氧化碳反应 |