题目内容
【题目】学习了盐酸的性质后,小军归纳出盐酸的五条化学性质(如图)。
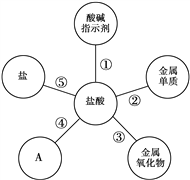
(1)为了验证性质①,小军将紫色石蕊溶液滴加到盐酸溶液中,溶液变______色;
(2)图中A所表示的物质类别是___________;试写出一个盐酸与该类别物质发生反应的化学方程式__________________________;
(3)为了验证性质⑤,可选用的物质是_______(填一种即可);
(4)镁和锌可以用来验证盐酸的性质②。现在小军要探究镁和锌与盐酸反应的快慢,下列因素不影响镁和锌与盐酸反应快慢的是_______(填序号);
A.盐酸的质量分数 B.温度
C.反应容器的大小 D.两种金属的形状
写出锌与盐酸发生反应的化学方程式_________________。
【答案】 红 碱, NaOH+HCl==NaCl+H2O(符合条件即可); 符合条件的盐即可; C Zn + 2HCl == ZnCl2 + H2↑
【解析】(1)紫色石蕊溶液遇盐酸变红。(2)盐酸有五条化学性质:与指示剂反应、与金属单质反应、与金属氧化物反应、与碱反应、与盐反应,故填碱。酸碱反应生成盐和水。(3)实验室可用稀盐酸与大理石(大理石主要成分是碳酸钙)反应来制取二氧化碳,CaCO3 + 2HCl == CaCl2 + H2O + CO2↑,可填碳酸钙。(4)A.盐酸的质量分数越大,反应速度越快,不符合题意;B.温度越高,反应速度越快,不符合题意;C.反应容器的大小与反应速度无关,符合题意;D.反应物之间接触面积越大,反应速度越快,不符合题意。故选C。锌与盐酸发生反应生成氯化锌和氢气。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目