题目内容
【题目】某化学兴趣小组对“氧化铜能否作过氧化氢分解的催化剂“进行了探究
(实验探究)
实验编号 | 实验操作 | 实验现象 | 实验分析或结论 | |
实验分析 | 实验结论 | |||
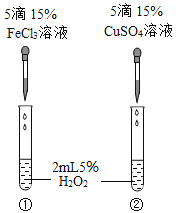
① |
| 有少量气泡;木条不复燃 | 过氧化氢能分解,但是 _________ | 氧化铜是过氧化氢分解的催化剂 |
② |
| __________________ | 氧化铜能加快过氧化氢分解 | |
(1)写出实验②中反应的化学方程式:___________________。
(交流反思)实验过程中加入到两支试管里的过氧化氢溶液应满足的要求有_________________。
①体积相同 ②浓度相同 ③温度相同
(2)小明同学认为仅由上述实验还不能完全得出表内的“总结”,他补充设计了以下两个探究实验
实验一:称量反应后固体质量,并与反应前的称量数据作比较,其目的是________________。
实验二:另取5mL5%的过氧化氢溶液于试管中,再向其中加入实验②反应后的固体剩余物,如图1所示,其目的是证明_______________________。
(实验拓展)小红同学用MnO2、CuO两种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球探究分解过氧化氢溶液制取氧气的适宜催化剂。
实验操作:取30粒含MnO2的海藻酸钠微球,采用图1装置进行实验。改用另一种微球,分别重复上述实验,得到图2的锥形瓶内压强随时间变化的曲线图。
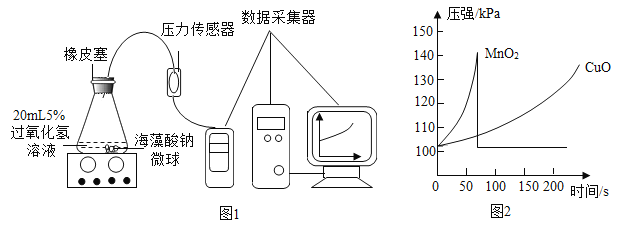
(3)每次实验时,海藻酸钠微球数应相同的原因是_____________。
(4)用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是_______________。
(5)从实验曲线看,催化效果较好、反应温和的催化剂是__________________。
【答案】反应速度太慢 有大量气泡产生,带火星的木条复燃 2H2O2![]() 2H2O+O2↑ ①② 证明反应前后氧化铜的质量不变 反应后氧化铜的化学性质不变 为了加入质量相等的催化剂,确保催化剂用量一致 产气速率过快,导致气压过大,橡胶塞被弹出 CuO
2H2O+O2↑ ①② 证明反应前后氧化铜的质量不变 反应后氧化铜的化学性质不变 为了加入质量相等的催化剂,确保催化剂用量一致 产气速率过快,导致气压过大,橡胶塞被弹出 CuO
【解析】
实验探究:过氧化氢能分解,但是分解的速率太慢,故带火星的木条不复燃;故填:反应速度太慢;氧化铜能加快过氧化氢的分解,故可以在试管中加入氧化铜,设计实验要注意控制变量,过氧化氢与实验①中的要一样,反应后观察到产生气泡速度快,且带火星的木条复燃,故填:有大量气泡产生,带火星的木条复燃;
(1)实验②中过氧化氢在氧化铜的催化作用下分解生成水和氧气,反应的化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
交流反思:
实验过程中加入到两支试管里的过氧化氢溶液应满足的要求有浓度、体积完全相同;
(2)要证明氧化铜是反应的催化剂,还需要证明反应前后氧化铜的质量和化学性质不变;(3)每次实验时,海藻酸钠微球数应相同的原因是为了加入催化剂的质量相等。故填:为了加入质量相等的催化剂,确保催化剂用量一致。
(4)用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,原因是产气速率过快,导致气压过大,橡胶塞被弹出;
(5)从实验曲线看,催化效果较好、反应温和的催化剂是氧化铜(CuO)。

 阅读快车系列答案
阅读快车系列答案【题目】木炭作为还原剂用于金属冶炼已有几千年历史。教材用如图Ⅰ实验介绍这一知识。
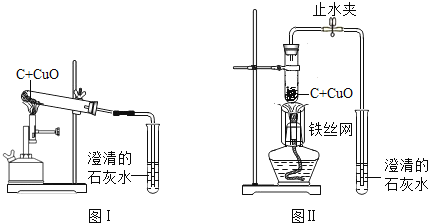
(1).木炭与氧化铜反应的化学方程式是______。
(2).酒精灯火焰处加有铁丝网罩,其作用是______。
(3).固定试管时,试管口要略向下倾斜,其目的是______。
(4).图Ⅰ与教材中的装置还是略作了改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止______。
(5).为了提高成功率,某研究小组设计如图Ⅱ方案进行实验。
(实验研究)
分别称取2g木炭与![]() 混合物,按每种比例重复实验3次。实验记录如下表:
混合物,按每种比例重复实验3次。实验记录如下表:
总质量相同(2g)但木炭与![]() 比例不同的实验对比表
比例不同的实验对比表
比例 | 1:6 | 1:7 | 1:8 | 1:9 | 1:10~1:11 | 1:12 | 1:13 |
加热时间 |
|
|
|
|
|
|
|
实验现象 | 红热,产生大量气泡,石灰水变浑浊 | 偶尔红热,气泡较少 | |||||
实验结果 | 表层铜球较大,出现未完全反应的黑色木炭粉末,且木炭含量越高黑色粉末越多 | 反应较完全,生成亮红色网状铜块 | 部分生成 | 主要产物是 | |||
由实验数据分析,除温度外,影响实验的因素是______;
从产物分析,该反应混合物的最佳比例范围是______。
(装置改进)
稳定的高温是本实验成功的关键因素之一,实验装置也会影响加热的效率。图Ⅱ装置将卧式装置改为直立式装置。实验时,将反应混合物夯实于试管底部,调节酒精灯使外焰完全包围试管的下部。你认为该设计是否更好?______(填“是”或“否”);理由是______。
(交流讨论)
由于试管中有空气,实验时应注意:
①混合物需进行预热,除了使试管受热均匀外,另外的目的是______。
②从理论上讲,并不能把石灰水变浑浊作为木炭跟![]() 开始反应的充分证据。其理由是______。
开始反应的充分证据。其理由是______。
【题目】某课外活动小组在学习了书本“空气中氧气含量测定”试验后,对该实验进行了改进。
(实验回顾)图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
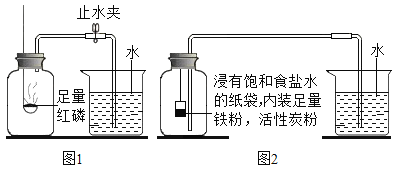
(1)写出红磷燃烧的符号表达式____________________________.
(2)写出该实验的现象__________________。
(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
(实验改进)
Ⅰ。根据铁在空气中生锈的原理设计图2实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈,通过铁生锈来消耗瓶中的氧气。
Ⅱ。测得实验数据如表
测量项目 | 实验前 | 实验后 | |
烧杯中水的体积 | 集气瓶(扣除内容物)和导管的容积 | 烧杯中剩余水的体积 | |
体积/mL | 80.0 | 126.0 | 54.5 |
(交流表达)
根据表中数据计算,改进实验后测得的空气中氧气的体积分数是___________(计算结果精确到0.1%).
改进后的实验优点是:_______________(写一条)。