题目内容
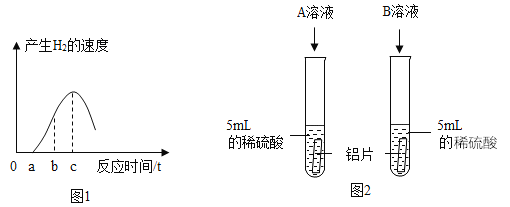
【题目】甲、乙的溶解度曲线如图所示(不考虑水的变化)。下列说法正确的是( )
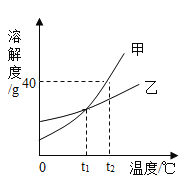
A. 根据溶解度曲线可判断,甲的溶解度比乙的大
B. t2℃时,甲的饱和溶液中溶质质量分数为40%
C. t2℃时,将甲、乙饱和溶液分别降温至t1℃,析出晶体甲的质量大
D. t1℃时,将甲、乙饱和溶液分别升温至t2℃,两溶液中溶质质量分数相等
【答案】D
【解析】
A、在比较物质的溶解度时,需要指明温度,故A错误;
B、t2℃时,甲的溶解度是40g,一定温度下饱和溶液的溶质质量分数=![]() ,甲的饱和溶液中溶质质量分数=
,甲的饱和溶液中溶质质量分数=![]() <40%,故B错误;
<40%,故B错误;
C、t2℃时,甲、乙的饱和溶液的质量不能确定,所以分別降温到t1℃,析出晶体的质量不能确定,故C错误;
D、t1℃时,将甲、乙的饱和溶液分别升温到t2℃,两物质的溶解度增大,溶质、溶剂质量都不会改变,所以两溶液中溶质质量分数相等,故D正确。故选D。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】为探究碳还原氧化铜的最佳实验条件,取木炭粉和氧化铜的干燥混合物1-2.5g用如图所示装置进行实验。
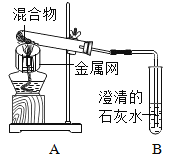
(1)木炭还原氧化铜的化学方程式为__。实验过程中A装置中试管内产生的现象是__。
(2)酒精灯火焰加金属网罩的目的是____。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+H2O+Cu
(进行试验)取一定量的混合物,用上图所示装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有较多黑色物质 | |
(结论与解释)(3)由上述实验可以得到的结论是___,条件最佳。
(反思与评价)
(4)为了检验生成的红色固体中是否含有Cu2O,所需试剂是____。
(5)该装置与教材中的装置相比略作改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止____。
【题目】关于下列事实的解释不正确的是( )
选项 | 事实 | 解释 |
A | 10mL酒精和10mL水混合后体积小于20mL | 分子之间有间隔 |
B | 稀硫酸和稀盐酸化学性质相似也存在差异 | 溶液中都含有H+ , 也存在不同的SO42-、Cl-离子 |
C | 酒精溶液不导电 | 溶液中没有自由移动的带电粒子 |
D | 化肥硫酸铵不能和熟石灰混放或混用 | 硫酸铵与熟石灰发生中和反应 |
A.A B.B C.C D.D
【题目】根据给出的KNO3和NaCl两种物质的溶解度表及溶解度曲线,回答问题。

温度/°C | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.7 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
(1)在60℃时,NaCl的溶解度为_____g。
(2)30℃时,硝酸钾饱和溶液和氯化钠饱和溶液各100g,分别蒸发掉10g水,恢复至30℃时,_____饱和溶液析出的晶体多。
(3)要将KNO3从其饱和溶液中全部结晶出来,应该采用的方法是_____(填“冷却热饱和溶液”或“蒸发溶剂”)