题目内容
【题目】铁(Fe)是应用广泛的活泼金属,能与酸反应、在潮湿的空气中容易生锈。
(1)写出铁和稀硫酸反应的化学方程式:_______________。
(2)铁在潮湿的空气中生锈需经过一系列反应, 完成第一步反应:![]() _________
_________![]()
(3)氢碘酸( HI )是类似于盐酸的一种强酸, 已知:![]() 。完成配比为1:1的H2SO4和HI混合稀溶液溶解Fe(OH)3的总化学反应方程式:_______________。
。完成配比为1:1的H2SO4和HI混合稀溶液溶解Fe(OH)3的总化学反应方程式:_______________。
【答案】![]() 2H2O
2H2O ![]()
【解析】
(1)铁与稀硫酸反应生成硫酸亚铁和氢气,该反应的化学方程式为:![]() ;
;
(2)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含2个铁原子、2个氧原子,生成物中含2个铁原子,4个氢原子、4个氧原子,故反应物中还应含4个氢原子、2个氧原子,故将化学方程式补充完整为:![]()
![]()
![]() ;
;
(3)氢氧化铁与硫酸反应生成硫酸铁和水,该反应的化学方程式为:![]() ,
,![]() ,故配比为1:1的H2SO4和HI混合稀溶液溶解Fe(OH)3的总化学反应方程式为:
,故配比为1:1的H2SO4和HI混合稀溶液溶解Fe(OH)3的总化学反应方程式为:![]() 。
。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
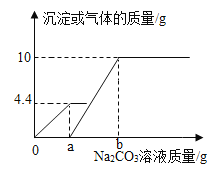
金博士一点全通系列答案【题目】如图表示某个化学反应过程中各物质质量与时间的关系,下列描述正确的是
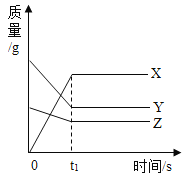
A.该反应是分解反应
B.X是反应物,Y和Z是生成物
C.t1时刻,反应物完全消耗完
D.t1时刻,X的质量等于Y和Z减少的质量之和
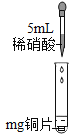
【题目】同学们通过学习知道铜与盐酸、稀硫酸不能发生反应,但却发现化学老师用铜与浓硝酸制备出了NO2气体去做物理实验。同学们对此很感兴趣,在实验室对铜与硝酸的反应进行了探究。
实验I | 实验II | ||
实验装置 | 实验现象 | 实验装置 | 实验现象 |
| 铜片逐渐消失, 有无色气泡产生,试管中上部有红棕色气体出现;溶液由无色变为蓝色 |
| 铜片逐渐消失, 产生红棕色气体,溶液由无色变为绿色 |
(探究一)实验I中产生的无色气体是什么?
(查阅资料)
(1)硝酸(HNO3)与Cu反应生成硝酸铜和含氮元素的化合物;硝酸铜溶液呈蓝色
(2)含氮元素的某些气态物质的物理性质
NH3 | NO | NO2 | |
颜色 | 无色 | 无色 | 红棕色 |
气味 | 刺激性 | 刺激性 | |
溶解性 | 极易溶于水 | 难溶于水 | 可溶于水或硝酸 |
(3)NO2与水反应生成无色的硝酸和NO气体
(猜想与假设)无色气体可能是:①NH3 ②NO
(进行实验)同学们利用下图装置对产生的无色气体进行检验。
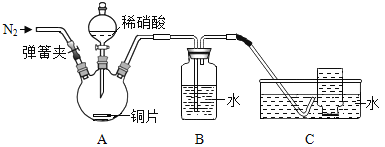
实验操作 | 实验现象 |
1. 打开弹簧夹,通入N2,一段时间后,关闭弹簧夹 | B、C中导管口有无色气泡冒出 |
2. 将C中导管伸入集气瓶中,打开分液漏斗的活塞,滴入一定量稀硝酸,关闭活塞 | A中有无色气泡产生 B中导管口有无色气泡冒出 C中集气瓶内收集到无色气体 |
3. 从水槽中取出集气瓶,敞口置于空气中 | 无色气体变为红棕色 |
4. 取少量B中液体于试管中,滴加无色酚酞溶液 | 试管中溶液颜色无明显变化 |
(解释与结论)
(1)操作1中,通入N2的目的是_____。
(2)同学们认为猜想①不正确,理由是_____。
(3)无色气体具有的化学性质是_____。
(探究二)为什么实验II中的溶液呈绿色而不是蓝色?
(猜想与假设)①溶液中硝酸铜的质量分数较高②硝酸铜溶液中溶解了生成的气体
(设计实验)同学们设计了以下4个实验方案。
方案1 | 配制饱和硝酸铜溶液并稀释至不同的浓度,观察溶液颜色变化 |
方案2 | 加水稀释实验II所得的绿色溶液,观察溶液颜色变化 |
方案3 | 取实验II所得的绿色溶液,加热,观察溶液颜色变化 |
方案4 | 配制饱和硝酸铜溶液,…… |
(反思与评价)
(1)“方案1”和“方案3”中,能验证猜想②的是_____。
(2)“方案2”不能验证猜想①的原因是_____。
(3)“方案4”也可验证猜想②,该方案是:配制饱和硝酸铜溶液,_____。
(4)通过实验I、II与已有知识的对比,可得出的结论是_____(答一条即可)。